
Charakterystyka Rickettsia rickettsii, zakażenie, leczenie
Rickettsia rickettsii Jest to bakteria należąca do klasy Alphaproteobacteria, należąca do heterogenicznego rodzaju Richesia, który jest rodową grupą, która zapoczątkowała mitochondria. Wszystkie bogactwa są chorobotwórcze R. rickettsii najbardziej zjadliwy z nich.
R. rickettsii jest to ściśle wewnątrzkomórkowy pasożyt komórek eukariotycznych. Jego naturalnymi żywicielami, rezerwuarami i wektorami są roztocze ixodoid, powszechnie znane jako kleszcze twarde. Te ostatnie to hematofagi ektopasożyty, to znaczy żywią się krwią.

Są wektorami R. rickettsii kleszcze: Dermacentor variabilis, D. andersoni, Rhipicephalus sanguineus Y Amblyomma cajennense.
Ricketsia nie przeżywa długo poza żywicielem, przenoszona przez stawonogi na potomstwo (przez jajniki) oraz ze zwierzęcia na zwierzę różnymi drogami..
Kleszcz uzyskuje bogactwo, gdy pobiera krew od zakażonego zwierzęcia. Wewnątrz kleszcza bogactwa wchodzą do komórek nabłonka jego przewodu pokarmowego i tam się namnażają. Następnie są one wypróżniane wraz z odchodami owada.

Kleszcz zaraża inne zwierzęta richetsią, poprzez swój ustny aparat (ponieważ ssąc krew, zaszczepia również zakażoną ślinę) lub poprzez odchody, które odkłada na skórze. Człowiek uczestniczy w cyklu bogactwa jako przypadkowy gospodarz.
Indeks artykułów
- 1 Funkcje
- 1.1 Morfologia
- 1.2 Mechanizm inwazji za pośrednictwem receptorów
- 1.3 W cytoplazmie komórki gospodarza
- 1.4 Metabolizm
- 1.5 Rozpowszechnianie w gospodarzu
- 2 Uprawa
- 2.1 Możliwa broń biologiczna
- 2.2 Poziom bezpieczeństwa biologicznego 3
- 2.3 Metody uprawy
- 3 Objawy zakażenia
- 3.1 Śmiertelność
- 4 Leczenie
- 4.1 Sterowanie wektorowe
- 4.2 Unikać narażenia
- 4.3 Usuwanie kleszcza
- 5 Referencje
Charakterystyka
R. rickettsii Jest czynnikiem zakaźnym dla wielu ssaków i jest patogenny dla ludzi, powodując gorączkę Gór Skalistych (FMR), gorączkę plamistą Gór Skalistych (FMMR) lub „gorączkę Q”..
Choroba ta jest przenoszona przez ukąszenie zakażonego kleszcza i dlatego objawia się sezonowo, związaną z pojawieniem się nosicieli lub uwarunkowaną zmianami ekologicznymi. Wzrost temperatury spowodowany globalną zmianą klimatu jest jednym z czynników sprzyjających uogólnionemu rozmieszczeniu wektora choroby.
Obecnie FMR jest uważana za chorobę występującą na całym świecie, chociaż wcześniej uważano ją za endemiczną dla leśnych obszarów Stanów Zjednoczonych, Ameryki Środkowej i Południowej..
Morfologia
R. rickettsii Jest to proteobakteria w postaci prątków bez wici, niewielkich rozmiarów (0,3 do 0,5 µm x 1 do 2 µm) i Gram-ujemna (choć z charakterystycznym wybarwieniem Giemsa).
Posiada podwójną błonę wewnętrzną z glikanów peptydowych i podwójną błonę zewnętrzną, a także ścianę komórkową z kwasem muramowym i diaminopimelinowym.
Zawiera mały genom (1 - 1,5 Mpb) i jest podzielony przez podział binarny, z czasem generacji 8 godzin.
Mechanizm inwazji za pośrednictwem receptorów
Richesia wnika do komórki gospodarza poprzez aktywny proces, który został dogłębnie zbadany R. conorii.
Uważa się, że Richesia wykorzystuje samo-transportowe białka błonowe (OmpB, OmpA, peptyd B, Adr1 lub Adr2) do wiązania się z innym białkiem błony komórkowej gospodarza, które jest zależną od DNA kinazą białkową (Ku70). Ta ostatnia pojawia się tylko w błonie komórki gospodarza, gdy występuje w obecności bogactwa.
Wreszcie aktyna cytoszkieletu komórki gospodarza zostaje zmieniona, a fagocytoza wywołana richetsią występuje po pochłonięciu przez fagosom..
W cytoplazmie komórki gospodarza
Po wejściu do cytoplazmy bogactwo pozwala uniknąć śmierci w wyniku fuzji fagolizosomalnej, uciekając z fagosomu.
R. rickettsii żyje swobodnie i rozmnaża się w cytoplazmie lub w jądrze komórkowym, gdzie ma dostęp do składników odżywczych komórki gospodarza. W ten sposób chroni się również przed odpowiedzią immunologiczną gospodarza.
Metabolizm
R. rickettsii nie spełnia wielu funkcji metabolicznych, co czyni go obowiązkowym pasożytem wewnątrzkomórkowym. Większość cząsteczek niezbędnych do wzrostu i namnażania (aminokwasy, nukleotydy, ATP) pobiera z komórki, na której pasożytuje..
Ma również bardzo charakterystyczny metabolizm energetyczny, ponieważ nie jest zdolny do utleniania glukozy ani kwasów organicznych, jak inne bakterie, będąc w stanie utleniać tylko kwas glutaminowy lub glutaminę.
Rozprzestrzeniaj się w hoście
R. rickettsii przemieszcza się pomiędzy sąsiednimi komórkami indukując polimeryzację aktyny cytoszkieletu komórki gospodarza. W ten sposób generuje wgłębienie błony i przechodzi do sąsiedniej komórki, unikając jej ekspozycji na układ odpornościowy gospodarza. Może również wysadzić komórkę gospodarza.
Rozprzestrzenianie się w organizmie żywiciela i do wszystkich jego narządów następuje najpierw przez naczynia limfatyczne, a następnie przez naczynia krwionośne. Infekuje wiele różnych komórek gospodarza kręgowców: komórki śródbłonka, komórki nabłonka, fibroblasty i makrofagi. U bezkręgowców infekuje komórki nabłonka.
Posiada zdolność infekowania owadów (kleszczy), gadów, ptaków i ssaków.
Kultura
Możliwa broń biologiczna
Rickettsia rickettsii Jest klasyfikowana jako możliwa broń biologiczna zgodnie z dokumentem „Reakcja zdrowia publicznego na broń biologiczną i chemiczną: przewodnik Światowej Organizacji Zdrowia (WHO)”.
Uważany jest za bardzo niebezpieczny mikroorganizm ze względu na swoje biologiczne cechy, takie jak: niska dawka zakaźna, będąca przyczyną dużej śmiertelności i zachorowalności, stabilność środowiska, niewielkie rozmiary i przenoszenie w postaci aerozolu (zakażenie może nastąpić przez błony śluzowe, spojówkowo lub drogami oddechowymi).
Poziom bezpieczeństwa biologicznego 3
Według United States Center for Disease Control and Prevention, R. rickettsii Jest to patogen Biobezpieczeństwa Poziomu 3. Oznacza to, że jego zagrożenie wymaga pewnych środków ostrożności podczas obchodzenia się z nim, takich jak:
- Laboratorium, w którym jest uprawiany, musi mieć określony projekt i cechy bezpieczeństwa (takie jak kliniczne laboratoria diagnostyczne, niektóre badania).
- Personel laboratorium musi znać i stosować protokoły postępowania z patogenami i czynnikami śmiercionośnymi.
- Należy przestrzegać zatwierdzonej standardowej procedury operacyjnej (SOP).
- Musi istnieć nadzór ekspertów w zakresie obsługi i bezpieczeństwa biologicznego.
- Manipulowanie szczepami musi odbywać się w przestrzeni bezpieczeństwa biologicznego.
Metody uprawy
Krzywicy nie można hodować na stałym lub płynnym agarze. Jego hodowla wymaga linii komórkowych (wolnych od antybiotyków) od gadów, ptaków i ssaków żywicieli..
Wśród linii komórkowych stosowanych do ich hodowli znajdują się między innymi: linie pochodzące z ludzkich lub innych fibroblastów ssaków, komórki nabłonka i śródbłonka, zarodki kurze i fibroblasty kleszcza..
W tradycyjnej uprawie wykorzystuje się zarodki kur (jaja) lub zwierząt podatnych na zakażenie krzywicą, np. Kleszczami. Inne, bardziej złożone formy kultury obejmują wykorzystanie krwi i tkanek ludzkich i zwierzęcych..
Niewiele laboratoriów przeprowadza ich identyfikację i izolację ze względu na złożoność i niebezpieczeństwo ich hodowli.
Objawy zakażenia
Okres inkubacji pryszczycy u ludzi wynosi od 10 do 14 dni po ukąszeniu zakażonego kleszcza (od zwierzęcia lub z otoczenia). Ta choroba ma następujące objawy:
- Podstawową chorobą jest zapalenie naczyń, czyli zmiany w śródbłonku naczyń krwionośnych, które zwiększają przepuszczalność naczyń włosowatych.
- Obrzęk na poziomie dotkniętych tkanek. Jeśli wystąpi w płucach lub mózgu, może być śmiertelny.
- Możliwe krwawienie.
- Ogólne uszkodzenie nerek i uszkodzenia ogólnoustrojowe.
- Typowe zmiany parchowo-wysypkowe z poczerniałą skórą w miejscu ukąszenia przez kleszcza.
- Nagła wysoka lub umiarkowana gorączka trwająca od dwóch do trzech tygodni.
- Dreszcze.
- Wysypka (wysypka lub czerwone plamy na skórze), rozpoczynająca się na ramionach lub nogach. Można je również znaleźć na podeszwach stóp lub dłoniach, później rozprzestrzeniając się na resztę ciała.
- Silny ból głowy.
- Silne bóle mięśni.
- Zmęczenie.
- Ból brzucha i stawów.
- Nudności, wymioty i utrata apetytu.
- Inne niespecyficzne objawy ogólne.
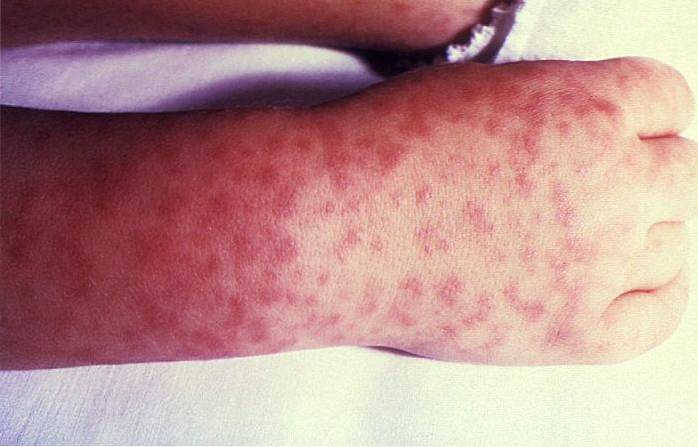
Śmiertelność
Przed opracowaniem antybiotyków FMR powodowała śmiertelność do 80% w niektórych regionach. Obecnie śmiertelność z powodu tej choroby waha się od 10 do 30%.
Obecnie nie ma dostępnej licencjonowanej szczepionki richetsjalnej.
Leczenie
FMR można kontrolować, jeśli zostanie wcześnie zdiagnozowana i jeśli jest leczona antybiotykami o szerokim spektrum działania, takimi jak: tetracykliny (doksycyklina) i chloramfenikol (chociaż wywołuje skutki uboczne).
W poniższej tabeli, zaczerpniętej z Quintero i wsp. (2012), zalecane dawki antybiotyków są pokazane w zależności od grupy wiekowej i stanu fizjologicznego pacjenta..

Profilaktyka
Sterowanie wektorowe
Kontrolowanie populacji kleszczy w lasach jest niezwykle trudne, co sprawia, że wytępienie pryszczycy jest prawie niemożliwe.
Unikać narażenia
Aby uniknąć ukąszeń przez kleszcze w zarażonych siedliskach, zaleca się noszenie jasnej odzieży, wsuwanie koszuli do spodni i zakładanie skarpet na krawędź spodni lub te ostatnie wewnątrz butów. Na koniec zaleca się sprawdzenie skóry pod koniec możliwej ekspozycji na kleszcze.
Środki odstraszające owady mogą być przydatne tylko wtedy, gdy są stosowane prawidłowo i we właściwych dawkach, ponieważ mogą być toksyczne.
Jeśli na skórze pojawi się kleszcz, istnieje ryzyko zarażenia R. rickettsii jest to minimalne, jeśli wektor można usunąć poprawnie w ciągu 4 godzin od połączenia.
W przypadku usuwania kleszczy ze zwierząt domowych należy używać rękawiczek.
Usunięcie kleszcza
W przypadku wykrycia kleszcza w ciele należy go ostrożnie usunąć, unikając regurgitacji, ponieważ zakażenie mogłoby zainfekować żywiciela. Jeśli to możliwe, zaleca się wykonanie tej procedury przez lekarza..
Jedynym zalecanym sposobem ich usunięcia jest użycie pęsety z wąskimi i zakrzywionymi końcówkami..
Kleszcza należy trzymać za obszar pyska (przymocowany do skóry żywiciela), unikając zmiażdżenia jego ciała. Następnie należy wykonać powolną, ale ciągłą przyczepność, aż zostanie usunięta ze skóry.
Jeśli jakakolwiek pozostała część aparatu ustnego pozostanie pod skórą, należy ją usunąć skalpelem lub igłą. Po usunięciu kleszcza należy zdezynfekować ugryziony obszar i ręce.
Bibliografia
- Abdad, M. Y., Abou Abdallah, R., Fournier, P.-E., Stenos, J., & Vasoo, S. (2018). Zwięzły przegląd epidemiologii i diagnostyki riketsjoz: Rickettsia and Orientia spp. Journal of Clinical Microbiology, 56 (8). doi: 10,1128 / jcm.01728-17
- Ammerman, N. C., Beier-Sexton, M. i Azad, A. F. (2008). Konserwacja laboratoryjna Rickettsia rickettsii. Aktualne protokoły w mikrobiologii, rozdział 3, dział 3A.5.
- McDade, J. E., & Newhouse, V. F. (1986). Historia naturalna Rickettsia Rickettsii. Annual Review of Microbiology, 40 (1): 287-309. doi: 10.1146 / annurev.mi.40.100186.001443
- Prescott, L. M. (2002). Mikrobiologia. Piąta edycja. McGraw-Hill Nauka / Inżynieria / Matematyka. pp 1147.
- Quintero V., J. C., Hidalgo, M. and Rodas G., J. D. (2012). Riquettsiosis, pojawiająca się i ponownie pojawiająca się śmiertelna choroba w Kolumbii. Universitas Scientiarum. 17 (1): 82-99.
- Walker, D. H. Rickettsiae. W: Baron S, redaktor. Mikrobiologia medyczna. Wydanie 4. Galveston (Teksas): oddział medyczny Uniwersytetu Teksasu w Galveston; 1996. Rozdział 38.


Jeszcze bez komentarzy