
Historia, właściwości, budowa, pozyskiwanie, zastosowania selenu
Plik selen Jest to niemetaliczny pierwiastek chemiczny, który należy do grupy 16 układu okresowego i jest reprezentowany przez symbol Se. Pierwiastek ten ma właściwości pośrednie między siarką a tellurem, które należą do tej samej grupy.
Selen został odkryty w 1817 roku przez Jöhsa J. Berzeliusa i Johna G. Gahna, którzy podczas odparowywania pirytu zaobserwowali czerwoną pozostałość (dolne zdjęcie). Początkowo pomylili to z tellurem, ale potem zdali sobie sprawę, że mają do czynienia z nowym pierwiastkiem.

Berzelius nazwał nowy pierwiastek selenem, opierając się na nazwie „selene”, co oznacza „bogini księżyca”. Selen jest niezbędnym pierwiastkiem śladowym dla roślin i zwierząt, chociaż w dużych stężeniach jest pierwiastkiem toksycznym.
Selen ma trzy główne formy alotropowe: czerwoną, czarną i szarą. Ten ostatni ma właściwość modyfikowania przewodnictwa elektrycznego w zależności od natężenia promieniującego go światła (fotoprzewodnika), do którego miał wiele zastosowań.
Selen jest szeroko rozpowszechniony w skorupie ziemskiej, jednak minerały, które go zawierają, nie są obfite, więc selen nie jest wydobywany.
Otrzymywany jest głównie jako produkt uboczny procesu rafinacji elektrolizy miedzi. Selen gromadzi się w mułu znajdującym się na anodzie elektrolizerów.
Istoty ludzkie posiadają około 25 selenoprotein, z których niektóre mają działanie przeciwutleniające i kontrolują wytwarzanie wolnych rodników. Istnieją również aminokwasy selenu, takie jak selenometionina i selenocysteina.
Indeks artykułów
- 1 Historia
- 1.1 Pierwsza obserwacja
- 1.2 Odkrycie
- 1.3 Pochodzenie jego nazwiska
- 1.4 Tworzenie aplikacji
- 2 Właściwości fizyczne i chemiczne
- 2.1 Wygląd
- 2.2 Standardowa masa atomowa
- 2.3 Liczba atomowa (Z)
- 2.4 Temperatura topnienia
- 2.5 Temperatura wrzenia
- 2.6 Gęstość
- 2.7 Ciepło topnienia
- 2.8 Ciepło parowania
- 2,9 Molowa pojemność cieplna
- 2.10 stopni utlenienia
- 2.11 Elektroujemność
- 2.12 Energia jonizacji
- 2.13 Porządek magnetyczny
- 2.14 Twardość
- 2.15 Izotopy
- 2.16 Alotropia
- 3 Reaktywność
- 3.1 Reakcja z wodorem
- 3.2 Reakcja z tlenem
- 3.3 Reakcja z halogenami
- 3.4 Reakcja z metalami
- 3.5 Selenity
- 3.6 Kwasy
- 4 Struktura i konfiguracja elektroniczna
- 4.1 - Selen i jego wiązania
- 4.2 - Pierścienie lub łańcuszki
- 4.3 - Allotropy
- 5 Gdzie znaleźć i produkcja
- 5.1 Elektroliza miedzi
- 6 Rola biologiczna
- 6.1 Niedobór
- 6.2 Kofaktor enzymatyczny
- 6.3 Białka i aminokwasy
- 7 Ryzyka
- 8 zastosowań
- 8.1 Kosmetyki
- 8.2 Lekarze
- 8.3 Elektroliza manganu
- 8.4 Pigment
- 8.5 Bęben światłoczuły
- 8.6 Kryształy
- 8.7 Wulkanizacja
- 8.8 Stopy
- 8.9 Prostowniki
- 9 Odniesienia
Fabuła
Pierwsza obserwacja
Alchemik Arnold de Villanova mógł zaobserwować selen w 1230 roku. Uczył się medycyny na paryskiej Sorbonie, a nawet był lekarzem papieża Klemensa V..
Villanova w swojej książce Rosarium Philosophorum opisuje czerwoną siarkę lub „rebeum siarki”, które pozostało w piecu po odparowaniu siarki. Ta czerwona siarka mogła być alotropem selenu.
Odkrycie
W 1817 roku Jöhs Jakob Berzelius i John Gottlieb Gahn odkryli selen w zakładzie chemicznym do produkcji kwasu siarkowego w pobliżu Gripsholm w Szwecji. Surowcem do produkcji kwasu był piryt, który był wydobywany z kopalni Falun..
Berzeliusa uderzyło istnienie czerwonej pozostałości, która pozostała w ołowianym pojemniku po spaleniu siarki.
Berzelius i Gahn zaobserwowali również, że czerwona pozostałość miała silny zapach chrzanu, podobny do zapachu telluru. Dlatego napisał do swojego przyjaciela Marecta, że uważają, że obserwowany osad to związek telluru..
Jednak Berselius kontynuował analizę materiału złożonego podczas spalania pirytu i ponownie uznał, że w kopalni Falun nie znaleziono telluru. W lutym 1818 doszedł do wniosku, że odkrył nowy pierwiastek.
Pochodzenie jego nazwy
Berzelius zwrócił uwagę, że nowy pierwiastek to połączenie siarki i telluru i że podobieństwo telluru do nowego pierwiastka dało mu możliwość nazwania nowej substancji selenem..
Berzelius wyjaśnił, że „tellus” oznacza boginię ziemi. Martin Klaport w 1799 roku nadał tę nazwę tellurium i napisał: „Żaden pojedynczy element nie jest tak nazwany. To musiało być zrobione! ".
Ze względu na podobieństwo telluru do nowej substancji, Berzelius nazwał go słowem selen, pochodzącym od greckiego słowa „selene”, które oznacza „boginię księżyca”..
Rozwój Twoich aplikacji
W 1873 roku Willoughby Smith odkrył, że przewodnictwo elektryczne selenu zależy od promieniującego go światła. Ta właściwość pozwoliła selenowi mieć liczne zastosowania.
Alexander Graham Bell w 1979 roku użył selenu w swoim fotofonie. Selen wytwarza prąd elektryczny proporcjonalny do natężenia światła, które je oświetla, stosowany w światłomierzach, mechanizmach zabezpieczających otwieranie i zamykanie drzwi itp..
Stosowanie prostowników selenowych w elektronice rozpoczęło się w latach trzydziestych XX wieku, mając liczne komercyjne zastosowania. W latach siedemdziesiątych został wyparty w prostownikach przez krzem.
W 1957 roku odkryto, że selen jest pierwiastkiem niezbędnym do życia ssaków, ponieważ był obecny w enzymach, które chronią przed reaktywnym tlenem i wolnymi rodnikami. Ponadto odkryto istnienie aminokwasów, takich jak selenometionina.
Fizyczne i chemiczne właściwości
Wygląd
Ponieważ istnieje kilka alotropów selenu, jego wygląd fizyczny jest różny. Zwykle występuje jako czerwonawe ciało stałe w postaci proszku.
Standardowa masa atomowa
78.971 u
Liczba atomowa (Z)
3. 4
Temperatura topnienia
221 ºC
Temperatura wrzenia
685 ºC
Gęstość
Gęstość selenu zmienia się w zależności od rozważanego alotropu lub odmiany polimorficznej. Niektóre z jego gęstości wyznaczonych w temperaturze pokojowej to:
Szary: 4,819 g / cm3
Alfa: 4,39 g / cm3
Ciało szkliste: 4,28 g / cm3
Stan ciekły (temperatura topnienia): 3,99 g / cm3
Ciepło topnienia
Szary: 6,69 kJ / mol
Ciepło parowania
95,48 kJ / mol
Molowa pojemność cieplna
25,363 J / (mol K)
Liczby utleniania
Selen może wiązać się w swoich związkach wykazując następujące liczby lub stany utlenienia: -2, -1, +1, +2, +3, +4, +5, +6. Wśród nich najważniejsze są -2 (Sedwa-), +4 (Se4+) i +6 (Se6+).
Na przykład w SeOdwa selen ma stopień utlenienia +4; to znaczy, zakłada się istnienie kationu Se4+ (Wiem4+LUBdwadwa-). Podobnie z SeO3 selen ma stopień utlenienia +6 (Se6+LUB3dwa-).
W selenowodorze H.dwaSe, selen ma stopień utlenienia -2; to znaczy ponownie zakłada się istnienie jonu lub anionu Sedwa- (H.dwa+wiemdwa-). Dzieje się tak, ponieważ selen jest bardziej elektroujemny niż wodór..
Elektroujemność
2,55 w skali Paulinga.
Energia jonizacji
-Pierwsza: 941 kJ / mol.
-Po drugie: 2045 kJ / mol.
-Po trzecie: 2973,7 kJ / mol.
Magnetyczny porządek
Diamagnetyczny.
Twardość
2,0 w skali Mohsa.
Izotopy
Istnieje pięć naturalnych i stabilnych izotopów selenu, które przedstawiono poniżej wraz z ich odpowiednią obfitością:
-74Se (0,86%)
-76Se (9,23%)
-77Se (7,6%)
-78Se (23,69%)
-80Se (49,8%)
Alotropia

Selen otrzymywany w reakcjach chemicznych jest ceglastoczerwonym bezpostaciowym proszkiem, który po szybkim stopieniu daje szklistą czarną postać, podobną do różańca (górne zdjęcie). Czarny selen to kruche i błyszczące ciało stałe.
Również czarny selen jest słabo rozpuszczalny w siarczku węgla. Po podgrzaniu tego roztworu do 180 ° C wytrąca się szary selen, jego najtrwalszy i najgęstszy alotrop..
Selen szary jest odporny na utlenianie i jest obojętny na działanie nieutleniających kwasów. Główną właściwością tego selenu jest jego fotoprzewodnictwo. Po oświetleniu przewodnictwo elektryczne wzrasta od 10 do 15 razy.
Reaktywność
Selen w jego związkach występuje na stopniach utlenienia -2, +4 i +6. Wykazuje wyraźną tendencję do tworzenia kwasów na wyższych stopniach utlenienia. Związki zawierające selen o stopniu utlenienia -2 nazywane są selenkami (Sedwa-).
Reakcja z wodorem
Selen reaguje z wodorem, tworząc selenowodór (H.dwaSe), bezbarwny, łatwopalny i cuchnący gaz.
Reakcja z tlenem
Selen spala się emitując niebieski płomień i tworząc dwutlenek selenu:
wiem8 (s) + 8 Odwa => 8 SeOdwa (s)
Tlenek selenu to stała, biała substancja polimerowa. Jego uwodnienie wytwarza kwas selenowy (H.dwaSeO3). Również selen tworzy trójtlenek selenu (SeO3), analogicznie do siarki (SO3).
Reakcja z halogenami
Selen reaguje z fluorem, tworząc sześciofluorek selenu:
wiem8 (s) + 24 F.dwa (g) => 8 SeF6 (l)
Selen reaguje z chlorem i bromem, tworząc odpowiednio dichlorek i dibromek disilenu:
wiem8 (s) + 4 Cldwa => 4 sedwaCldwa
wiem8 (s) + 4 Brdwa => 4 sedwaBrdwa
Selen może również tworzyć SeF4 i SeCl4.
Z drugiej strony selen tworzy związki, w których jeden atom selenu łączy się z jednym atomem halogenu, a drugim atomem tlenu. Ważnym przykładem jest tlenochlorek selenu (SeOdwaCldwa), z selenem na stopniu utlenienia +6, niezwykle silnym rozpuszczalnikiem.
Reakcja z metalami
Selen reaguje z metalami, tworząc selenki glinu, kadmu i sodu. Poniższe równanie chemiczne odpowiada równaniu dla tworzenia selenku glinu:
3 Se8 + 16 Al => 8 Aldwawiem3
Selenity
Selen tworzy sole zwane seleninami; na przykład: selenin srebra (AgdwaSeO3) i selenin sodu (NadwaSeO3). Nazwa ta została użyta w kontekście literackim w odniesieniu do mieszkańców Księżyca: Selenitów.
Kwasy
Najważniejszym kwasem selenu jest kwas selenowy (H.dwaSeO4). Jest tak mocny jak kwas siarkowy i łatwiej go redukować.
Struktura i konfiguracja elektroniczna
- Selen i jego związki
Selen ma sześć elektronów walencyjnych, dlatego znajduje się w grupie 16, podobnie jak tlen i siarka. Te sześć elektronów znajduje się na orbitali 4s i 4p, zgodnie z ich konfiguracją elektroniczną:
[Ar] 3d10 4sdwa 4p4
Dlatego musi, podobnie jak siarka, utworzyć dwa wiązania kowalencyjne, aby uzupełnić swój oktet walencyjny; chociaż ma dostępne orbitale 4d do łączenia się z więcej niż dwoma atomami. W ten sposób trzy atomy selenu łączą się i tworzą dwa wiązania kowalencyjne: Se-Se-Se.
Selen o największej masie atomowej ma naturalną tendencję do tworzenia struktur rządzonych wiązaniami kowalencyjnymi; zamiast układać się w dwuatomowe cząsteczki Sedwa, Se = Se, analogicznie do Odwa, O = O.
- Pierścionki lub łańcuszki
Spośród struktur molekularnych, które przyjmują atomy selenu, można ogólnie wymienić dwie: pierścienie lub łańcuchy. Zauważ, że w hipotetycznym przypadku Se3, atomy Se na końcach nadal wymagają elektronów; dlatego muszą być kolejno wiązane z innymi atomami, dopóki łańcuch nie zostanie zamknięty w pierścień.
Najpopularniejsze pierścienie to ośmioczłonowe pierścienie lub atomy selenu:8 (korona selenitowa). Dlaczego osiem? Ponieważ im mniejszy pierścień, tym bardziej będzie się stresował; to znaczy, kąty ich wiązań odbiegają od naturalnych wartości ustalonych przez ich hybrydyzacje sp3 (podobnie jak w przypadku cykloalkanów).
Ponieważ atomów jest osiem, separacja między atomami Se-Se jest wystarczająca, aby ich wiązania były „rozluźnione”, a nie „zagięte”; chociaż kąt jego ogniw wynosi 105,7º, a nie 109,5º. Z drugiej strony mogą występować mniejsze pierścienie:6 i7.
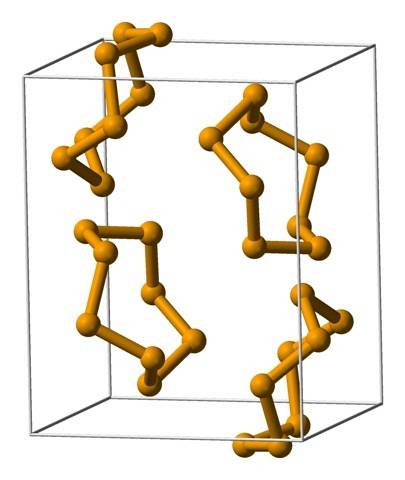
Górne zdjęcie przedstawia jednostki pierścienia Se.8. Zwróć uwagę na podobieństwo, jakie mają do koron siarkowych; tylko one są większe i cięższe.
Oprócz pierścieni atomy selenu można również układać w spiralne łańcuchy (pomyśl o spiralnych schodach):
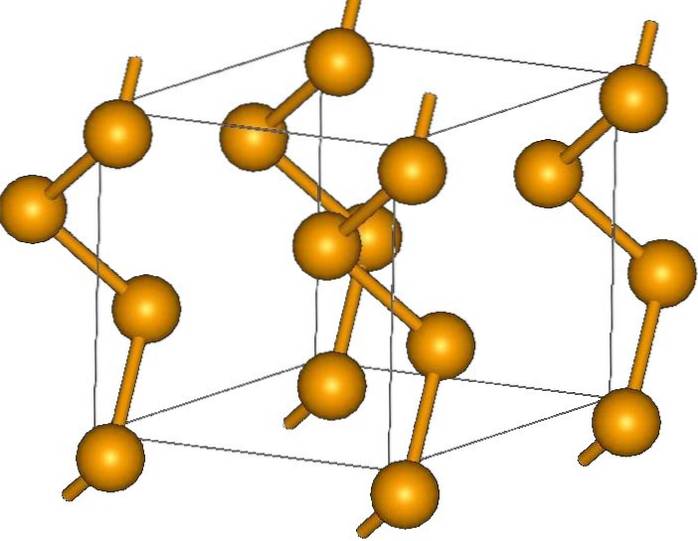
Na jego końcach mogą znajdować się końcowe wiązania podwójne (-Se = Se) lub pierścienie Se8.
- Allotropy
Biorąc pod uwagę, że mogą istnieć spiralne pierścienie lub łańcuchy selenu, a ich wymiary mogą się również różnić w zależności od liczby zawartych w nich atomów, to jest oczywiste, że istnieje więcej niż jeden alotrop dla tego pierwiastka; to znaczy czyste ciała stałe selenu, ale o różnych strukturach molekularnych.
Selen czerwony
Wśród najbardziej znanych alotropów selenu znajduje się czerwień, która może występować jako bezpostaciowy proszek lub jako kryształy jednoskośne i polimorficzne (patrz zdjęcie Se8).
W amorficznym czerwonym selenie struktury są nieuporządkowane, bez widocznych wzorów; podczas gdy w soczewce pierścienie tworzą strukturę jednoskośną. Selen czerwony krystaliczny jest polimorficzny, ma trzy fazy: α, β i γ, które różnią się gęstością..
Czarny selen
Struktura selenu czarnego również składa się z pierścieni; ale nie z ośmiu członków, ale z wielu innych, sięgających do pierścieni tysiąca atomów (Se1000). Mówi się wtedy, że jego struktura jest złożona i składa się z pierścieni polimerowych; niektóre większe lub mniejsze niż inne.
Ponieważ istnieją pierścienie polimerowe o różnych rozmiarach, trudno oczekiwać od nich ustalenia porządku strukturalnego; więc czarny selen jest również amorficzny, ale w przeciwieństwie do wspomnianego wyżej czerwonawego proszku ma szklistą teksturę, chociaż jest kruchy.
Selen szary
I wreszcie, z najprostszych alotropów selenu jest szary, który wyróżnia się spośród innych, ponieważ jest najbardziej stabilny w normalnych warunkach, a także ma metaliczny wygląd..
Jego kryształy mogą być heksagonalne lub trygonalne, ustalone przez siły dyspersyjne Londynu między polimerowymi łańcuchami helikalnymi (górny obraz). Kąt ich wiązań wynosi 130,1º, co wskazuje na dodatnie odchylenie od czworościennego otoczenia (przy kątach 109,5º)..
Dlatego łańcuchy spiralne selenu sprawiają wrażenie „otwartych”. W drodze elukubracji, w tej strukturze atomy są zwrócone ku sobie, więc teoretycznie musi istnieć większe nakładanie się ich orbitali, aby utworzyć pasma przewodnictwa.
Ciepło wraz ze wzrostem drgań molekularnych uszkadza te pasma, gdy łańcuchy ulegają zaburzeniu; podczas gdy energia fotonu wpływa bezpośrednio na elektrony, pobudzając je i pobudzając ich transakcje. Z tego punktu widzenia „łatwo” jest wyobrazić sobie fotoprzewodnictwo selenu szarego..
Gdzie się znajduje i produkcja
Chociaż selen jest szeroko rozpowszechniony, jest rzadkim pierwiastkiem. Występuje w swoim rodzimym stanie związanym z siarką i minerałami, takimi jak eukairit (CuAgSe), klaustalit (PbSe), naumanit (AgdwaSe) i crookesite [(CuTiAg)dwaWiem].
Selen występuje jako zanieczyszczenie, które zastępuje siarkę w niewielkiej części siarkowych minerałów metali; takie jak miedź, ołów, srebro itp..
Istnieją gleby, w których selen występuje w rozpuszczalnej postaci selenianów. Są one przenoszone przez wodę deszczową do rzek, a stamtąd do oceanu.
Niektóre rośliny są w stanie wchłonąć i skoncentrować selen. Na przykład filiżanka orzechów brazylijskich zawiera 544 µg selenu, co odpowiada 777% dziennej zalecanej ilości selenu..
U istot żywych selen znajduje się w niektórych aminokwasach, takich jak: selenometionina, selenocysteina i metyloselenocysteina. Selenocysteina i selenin są redukowane do selenowodoru.
Elektroliza miedzi
Nie ma wydobycia selenu. Większość z nich jest otrzymywana jako produkt uboczny procesu rafinacji elektrolizy miedzi, znajdując się w mułu, który gromadzi się na anodzie..
Pierwszym krokiem jest produkcja dwutlenku selenu. W tym celu szlam anodowy jest traktowany węglanem sodu w celu jego utlenienia. Następnie do tlenku selenu dodaje się wodę i zakwasza do kwasu selenowego..
Na koniec kwas selenowy poddaje się działaniu dwutlenku siarki, aby go zredukować i uzyskać selen pierwiastkowy..
W innej metodzie w mieszaninie mułu i szlamu powstałej przy produkcji kwasu siarkowego otrzymuje się zanieczyszczony selen czerwony, który rozpuszcza się w kwasie siarkowym..
Następnie powstaje kwas selenowy i kwas selenowy. Ten kwas selenowy jest traktowany tak samo, jak poprzednia metoda.
Chlor, który działa na selenki metali, może być również używany do produkcji lotnych chlorowanych związków selenu; takie jak: SedwaCldwa, SeCl4, SeCldwa i SeOCldwa.
Związki te w procesie przeprowadzanym w wodzie są przekształcane w kwas selenowy, który jest traktowany dwutlenkiem siarki w celu uwolnienia selenu..
Rola biologiczna
Niedobór
Selen jest niezbędnym pierwiastkiem śladowym dla roślin i zwierząt, których niedobór u ludzi spowodował poważne zaburzenia, takie jak choroba Keshana; choroba charakteryzująca się uszkodzeniem mięśnia sercowego.
Ponadto niedobór selenu jest związany z niepłodnością męską i może odgrywać rolę w chorobie Kashin-Becka, typie choroby zwyrodnieniowej stawów. Niedobór selenu obserwowano również w reumatoidalnym zapaleniu stawów.
Kofaktor enzymatyczny
Selen jest składnikiem enzymów o działaniu przeciwutleniającym, takich jak peroksydaza glutationowa i reduktaza tioredoksyny, które eliminują substancje z reaktywnym tlenem..
Dodatkowo selen jest kofaktorem deiodinaz hormonów tarczycy. Enzymy te odgrywają ważną rolę w regulacji funkcjonowania hormonów tarczycy..
Donoszono o stosowaniu selenu w leczeniu choroby Hasimoto, choroby autoimmunologicznej, w której wytwarzane są przeciwciała przeciwko komórkom tarczycy.
Selen był również stosowany w celu zmniejszenia toksycznego wpływu rtęci, ponieważ niektóre z jej działań wywierane są na enzymy przeciwutleniające zależne od selenu.
Białka i aminokwasy
Człowiek ma około 25 selenoprotein, które działają antyoksydacyjnie w celu ochrony przed stresem oksydacyjnym, inicjowanym przez nadmiar reaktywnych form tlenu (RFT) i reaktywnych form azotu (NOS)..
U ludzi wykryto obecność aminokwasów selenometiocyny i selenocysteiny. Selenometionina stosowana jest jako suplement diety w leczeniu stanów niedoboru selenu.
Ryzyka
Wysokie stężenie selenu w organizmie może mieć wiele szkodliwych skutków dla zdrowia, począwszy od łamliwych włosów i łamliwych paznokci, po wysypki skórne, ciepło, obrzęk skóry i silny ból.
Podczas leczenia selenu w kontakcie z oczami, ludzie mogą odczuwać pieczenie, podrażnienie i łzawienie. Tymczasem długotrwałe narażenie na dym bogaty w selen może powodować obrzęk płuc, oddech czosnku i zapalenie oskrzeli..
Dodatkowo osoba może doświadczyć zapalenia płuc, nudności, dreszczy, gorączki, bólu gardła, biegunki i powiększenia wątroby..
Selen może wchodzić w interakcje z innymi lekami i suplementami diety, takimi jak leki zobojętniające sok żołądkowy, leki przeciwnowotworowe, kortykosteroidy, niacyna i pigułki antykoncepcyjne..
Selen wiąże się ze zwiększonym ryzykiem raka skóry. Badanie przeprowadzone przez National Cancer Institute wykazało, że mężczyźni z wysokim poziomem selenu w organizmie dwukrotnie częściej chorowali na agresywnego raka prostaty.
Badania wskazują, że dzienne spożycie 200 µg selenu zwiększa o 50% możliwość rozwoju cukrzycy typu II.
Aplikacje
Kosmetyki
Siarczek selenu stosowany jest w leczeniu łojotoku, włosów przetłuszczających się lub z łupieżem.
Lekarze
Jest stosowany jako lek alternatywny w leczeniu choroby Hasimoto, autoimmunologicznej choroby tarczycy.
Selen zmniejsza toksyczność rtęci, jedna z jego toksycznych aktywności jest wywierana na enzymy odtleniające, które wykorzystują selen jako kofaktor.
Elektroliza manganu
Zastosowanie tlenku selenu w elektrolizie manganu znacznie obniża koszty tej techniki, gdyż zmniejsza zużycie energii elektrycznej.
Pigment
Selen jest stosowany jako pigment w farbach, tworzywach sztucznych, ceramice i szkle. W zależności od użytego selenu, kolor szkła waha się od głębokiej czerwieni do jasnopomarańczowej..
Fotoprzewodzący
Ze względu na właściwość selenu szarego do zmiany przewodnictwa elektrycznego w funkcji natężenia promieniującego go światła, selen znalazł zastosowanie w kserokopiarkach, fotokomórkach, fotometrach i ogniwach słonecznych..
Zastosowanie selenu w kserokopiarkach było jednym z głównych zastosowań selenu; ale pojawienie się organicznych fotoprzewodników zmniejsza ich wykorzystanie.
Kryształy
Selen służy do odbarwiania okularów w wyniku obecności żelaza, które daje zielone lub żółte zabarwienie. Dodatkowo pozwala na zabarwienie szkła na czerwono w zależności od przeznaczenia, jakie chcesz mu nadać..
Wulkanizacja
Selen dietyloditiowęglanowy jest stosowany jako środek wulkanizujący w produktach gumowych.
Stopy
Selen jest używany w połączeniu z bizmutem w mosiądzu w celu zastąpienia ołowiu; Silnie toksyczny pierwiastek, który zmniejsza swoje wykorzystanie ze względu na zalecenia organizacji zdrowotnych.
Selen jest dodawany w małych stężeniach do stali i stopów miedzi w celu poprawy użyteczności tych metali..
Prostowniki
Prostowniki selenowe zaczęto stosować w 1933 roku aż do lat 70-tych XX wieku, kiedy to zastąpiono je krzemem ze względu na jego niski koszt i najwyższą jakość..
Bibliografia
- Królewski Australijski Instytut Chemiczny. (2011). Selen. [PDF]. Odzyskany z: raci.org.au
- Wikipedia. (2019). Selen. Odzyskane z: en.wikipedia.org
- Sato Kentaro. (s.f.). Nowe alotropy głównych elementów grupy. [PDF]. Odzyskany z: tcichemicals.com
- Dr Dough Stewart. (2019). Fakty dotyczące pierwiastka selenu. Chemicool. Źródło: chemicool.com
- Robert C. Brasted. (28 sierpnia 2019). Selen. Encyclopædia Britannica. Odzyskany z: britannica.com
- Marques Miguel. (s.f.). Selen. Odzyskany z: nautilus.fis.uc.pt
- Helmenstine, dr Anne Marie (03 lipca 2019). Fakty dotyczące selenu. Odzyskany z: thinkco.com
- Lenntech B. V (2019). Układ okresowy: selen. Odzyskany z: lenntech.com
- Tinggi U. (2008). Selen: jego rola jako przeciwutleniacza dla zdrowia ludzkiego. Zdrowie środowiskowe i medycyna zapobiegawcza, 13(2), 102-108. doi: 10.1007 / s12199-007-0019-4
- Biuro Suplementów Diety. (9 lipca 2019). Selen: zestawienie faktów dla pracowników służby zdrowia. Narodowy Instytut Zdrowia. Odzyskany z: ods.od.nih.gov



Jeszcze bez komentarzy