
Szeregi widmowe
Plik serie widmowe Składają się z zestawu kolorowych linii na ciemnym tle lub jasnych pasków oddzielonych ciemnymi obszarami, które emitują światło ze wszystkich rodzajów substancji..
Te linie są wizualizowane za pomocą spektrometru, urządzenia składającego się z pryzmatu lub drobno podzielonej siatki, zdolnego do oddzielenia różnych składników światła..
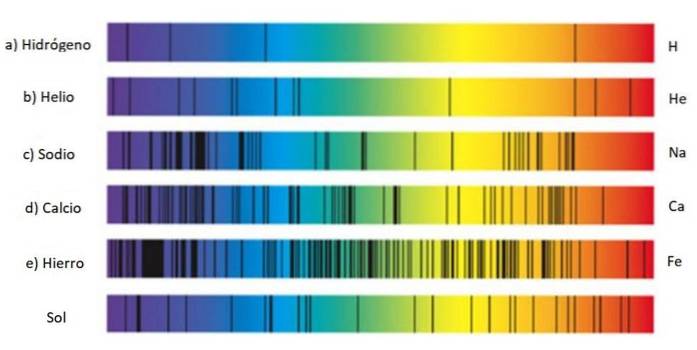
Te zestawy linii nazywane są widmo a każda substancja ma charakterystyczne widmo, rodzaj odcisku palca, który służy do identyfikacji jej obecności w świetle pochodzącym z przedmiotu. Dzieje się tak, ponieważ każdy atom ma własną konfigurację elektronową i dozwolone poziomy energii..
Dlatego znajdowanie linii widmowych jest techniką szeroko stosowaną przez astronomów do badania składu gwiazd na podstawie światła, które emitują. W rzeczywistości wszystko, co astronomowie wiedzą o gwiazdach, pochodzi z ich widm, czy to emisji, czy absorpcji..
Pochodzenie widm
Obecność widm wynika z konfiguracji atomowej. W efekcie elektrony są trzymane wokół jądra w regionach zwanych orbitale, znajduje się w dyskretnych odległościach od niego.
Na przykład w wodorze, najprostszym elemencie, promienie orbity są określone przez 0,053 ∙ ndwa nanometry, gdzie n = 1, 2, 3, 4,…. Wartości pośrednie między nimi są niedozwolone, dlatego mówi się, że orbitale są kwantowane. Kwantowany jest również stan energetyczny każdego orbitalu.
Takie ograniczenia powodują, że elektrony zachowują się zarówno jako cząstki, jak i jako fale, podobnie jak światło. Jednak elektrony mogą przechodzić z jednego orbitalu na drugi, zmieniając stan energetyczny atomu..
Pochłanianie i emisja energii elektromagnetycznej
Na przykład, jeśli elektron przechodzi z bardziej wewnętrznego orbitalu, o niższej energii, na bardziej zewnętrzny i energetyczny, konieczne jest, aby pozyskał niezbędną energię elektromagnetyczną, która jest przechowywana w atomie. Ten proces nazywa się wchłanianie.
Z drugiej strony, jeśli elektron przechodzi z orbity zewnętrznej do orbitalnej bardziej wewnętrznej, w przejściu emitowany jest foton w postaci światła, które jest energią odpowiadającą różnicy energii między orbitalami. Długość fali odpowiada tej różnicy i jest określona wzorem:

- E to energia
- λ jest długością fali
- h jest stałą Plancka
- c to prędkość światła
Rodzaje widm
Wytwarzane są zarówno widma absorpcyjne, jak i emisyjne, które zależą od pewnych parametrów obiektu lub substancji, takich jak gęstość i temperatura. Widmo rzadkiego gazu różni się od widma ciała stałego w wysokiej temperaturze.
Ciągłe widmo
Niektóre źródła emitują widma, których kolorowe linie zmieniają się płynnie i zawierają wszystkie kolory. Nazywa się to widmem ciągłym, na przykład wytwarzanym przez żarnik żarówki.
Spektrum emisji
To ten, który emitują pewne gorące substancje i składa się z kilku linii o określonej długości fali.
Ten typ widma jest wytwarzany przez gorące, cienkie gazy, takie jak te, które wypełniają świetlówki. Zorza polarna to kolejny przykład emisji, która występuje w gazach w górnych warstwach atmosfery Ziemi. Niektóre międzygwiazdowe obłoki gazów również wytwarzają widma emisyjne..
Widmo absorpcji
To widmo jest odbierane, gdy światło z bardzo gorącego, gęstego obiektu przechodzi przez chłodniejszy gaz. Widoczne są w nim prawie wszystkie kolory, ale niektóre wydają się zmniejszone i pojawiają się ciemne prążki na tych długościach fal, które są absorbowane przez atomy lub cząsteczki gazu..
Prawa spektroskopii Kirchoffa
Prawa spektroskopii Kirchoffa wskazują, w jakich warunkach powstają różne widma opisane powyżej:
- Widma ciągłe: są emitowane przez dowolny obiekt pod wysokim ciśnieniem i temperaturą.
- Widma emisyjne: są wytwarzane przez gorący gaz pod niskim ciśnieniem, który emituje linie o dobrze określonych długościach fal, odpowiadających przejściom elektronowym odpowiadającym każdemu elementowi, który tworzy gaz.
- Widma absorpcyjne: są wytwarzane przez gazy o niskich temperaturach znajdujące się w pobliżu źródeł ciągłego promieniowania. Atomy lub cząsteczki gazu pochłaniają tylko określone długości fal.
Widmo emisyjne wodoru
Szczególnie ważne jest widmo emisyjne wodoru, który jest najliczniejszym pierwiastkiem w całym wszechświecie i zawiera wiele ważnych informacji o gwiazdach i Drodze Mlecznej..
Seria linii widma wodoru została odkryta przez różnych badaczy i każda nosi jego imię.
Seria Balmera
Wodór emituje kilka linii w widmie widzialnym: kiedy elektron rozpada się z orbity 3 na orbital 2, emituje światło czerwone, którego długość fali wynosi 656,6 nm, a jeśli rozpada się z orbity 4 do orbitalu 2, to emituje niebieskie światło 486,1 nm.

W 1885 r. (Zanim Bohr zaproponował swoją teorię) szwajcarski matematyk i profesor Johann Balmer (1825-1898) znalazł metodą prób i błędów wzór do określania długości fal λ tych linii:

Gdzie:
- R jest stałą Rydberga: 1,097 × 107 m-1
- n = 3, 4, 5…., czyli n ≥ 3 (liczba całkowita).
Na przykład dla n = 3 w równaniu Balmera:

Odpowiada czerwonej linii po prawej stronie, pokazanej na powyższym rysunku. Odkrycie serii Balmera skłoniło innych naukowców do poszukiwania linii w pozostałym zakresie widma wodoru i innych gazów..
Seria Lyman
Zauważ, że widmo wodoru pokazane na rysunku zawiera linie ultrafioletowe, dwie skrajnie lewe, których długości fal wynoszą 397,0 nm i 388,9 nm. nm.
Rzeczywiście, te linie ultrafioletowe odpowiadają tak zwanej serii Lymana, odkrytej w 1906 roku przez fizyka Theodore'a Lymana. Jego formuła to:

Seria Paschen
Szereg Paschena został odkryty przez niemieckiego fizyka Friedericha Paschena w 1908 roku i jest ważny dla n ≥ 4, to jest: n = 4, 5, 6 ...

Linie Paschena znajdują się w bliskiej podczerwieni, a ostateczny poziom to n = 3, to znaczy ich wartości pojawiają się, gdy elektron rozpada się z wyższych poziomów do n = 3. Ponieważ szereg Lymana znajduje się w ultrafiolecie, można wnioskować że seria Balmera leży między Lymanem i Paschenem.
Seria Brackett
Ta seria, odkryta w 1922 r. Przez Fredericka Bracketta, amerykańskiego fizyka, znajduje się w dalekiej podczerwieni i składa się z linii widmowych odpowiadających przejściom wodoru rozpoczynającym się od n = 5 i kontynuując:

Seria Pfund
Seria Pfund została znaleziona w 1924 roku przez północnoamerykańskiego fizyka Augusta Hermanna Pfunda i odnosi się do przejść rozpoczynających się przy n = 5 w paśmie dalekiej podczerwieni:

- Arny, T. 2017. Explorations: An Introduction to Astronomy. 8th. Ed. McGraw Hill.
- Bauer, W. 2011. Fizyka dla inżynierii i nauki. Tom 2. Mc Graw Hill.
- Chang, R. 2013. Chemistry. 11th. Wydanie. Mc Graw Hill Education.
- Sears, Zemansky. 2016. Fizyka uniwersytecka z fizyką współczesną. 14. Ed. Tom 2. Pearson.
- Okna otwarte na wszechświat. Różne klasy widm. Odzyskany z: media4.obspm.fr.
Jeszcze bez komentarzy