
Struktura, właściwości i zastosowanie siarczku cynku (ZnS)
Plik siarczek cynku jest nieorganicznym związkiem o wzorze ZnS, utworzone przez kationy Zndwa+ i S anionydwa-. W naturze występuje głównie jako dwa minerały: wurtzyt i sfaleryt (lub blenda cynkowa), przy czym ten ostatni jest jego główną formą.
Sfaleryt ma czarny charakter ze względu na występujące w nim zanieczyszczenia. W czystej postaci ma białe kryształy, natomiast wurtzyt ma szaro-białe kryształy..

Siarczek cynku jest nierozpuszczalny w wodzie. Może powodować szkody w środowisku, ponieważ przenika do gleby i zanieczyszcza wody gruntowe oraz ich prądy.
Siarczek cynku można wytwarzać między innymi w wyniku korozji i neutralizacji.
Przez korozję:
Zn + HdwaS => ZnS + Hdwa
Neutralizacja:
H.dwaS + Zn (OH)dwa => ZnS + 2HdwaLUB
Siarczek cynku jest fosforyzującą solą, dzięki czemu ma wiele zastosowań i zastosowań. Ponadto jest półprzewodnikiem i fotokatalizatorem.
Indeks artykułów
- 1 Struktura
- 1.1 Blenda cynkowa
- 1.2 Wurzita
- 2 Właściwości
- 2.1 Kolor
- 2.2 Temperatura topnienia
- 2.3 Rozpuszczalność w wodzie
- 2.4 Rozpuszczalność
- 2.5 Gęstość
- 2.6 Twardość
- 2.7 Stabilność
- 2.8 Rozkład
- 3 Nazewnictwo
- 3.1 Systematyczne i tradycyjne nazewnictwo
- 4 Zastosowania
- 4.1 Jako pigmenty lub powłoki
- 4.2 Ze względu na fosforescencję
- 4.3 Półprzewodnik, fotokatalizator i katalizator
- 5 Referencje
Struktura
Siarczek cynku przyjmuje struktury krystaliczne, na które wpływają przyciąganie elektrostatyczne między kationem Zndwa+ a anion S.dwa-. Są to dwa: sfaleryt lub blenda cynkowa i wurzit. W obu przypadkach jony minimalizują odpychanie między jonami o równych ładunkach..
Blenda cynkowa jest najbardziej stabilna w ziemskich warunkach ciśnienia i temperatury; a wurzit, który jest mniej gęsty, wynika z przegrupowania krystalicznego w wyniku podwyższonej temperatury.
Te dwie struktury mogą współistnieć w tym samym ciele stałym ZnS w tym samym czasie, chociaż bardzo powoli wurzite będzie dominował..
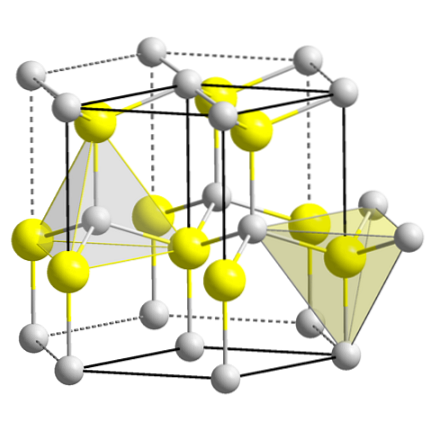
Mieszanka cynku

Górny obraz przedstawia sześcienną komórkę elementarną wyśrodkowaną na powierzchniach struktury z mieszanki cynku. Żółte kule odpowiadają anionom S.dwa-, a szare do kationów Zndwa+, znajduje się w rogach i na środku ścian sześcianu.
Zwróć uwagę na czworościenne geometrie wokół jonów. Blenda cynkowa może być również reprezentowana przez te czworościany, których otwory wewnątrz kryształu mają tę samą geometrię (otwory czworościenne).
Podobnie w komórkach elementarnych proporcja ZnS jest zachowana; to znaczy stosunek 1: 1. Tak więc dla każdego kationu Zndwa+ jest anion S.dwa-. Na obrazie może się wydawać, że szare kule są obfite, ale w rzeczywistości, ponieważ znajdują się w rogach i środku ścian sześcianu, są one wspólne dla innych komórek.
Na przykład, jeśli weźmiesz cztery żółte kule, które znajdują się w pudełku, „kawałki” wszystkich szarych kul wokół niego powinny być równe (i tak robią) cztery. Zatem w sześciennej komórce elementarnej znajdują się cztery Zndwa+ i cztery S.dwa-, spełnienie stosunku stechiometrycznego ZnS.
Należy również podkreślić, że przed i za żółtymi kulami (przestrzeń, która je oddziela) znajdują się czworościenne otwory..
Wurzita
W przeciwieństwie do struktury blendy cynku, wurzite przyjmuje sześciokątny system kryształów (górne zdjęcie). Jest to mniej zwarte, więc ciało stałe ma mniejszą gęstość. Jony w wurzycie mają również czworościenne otoczenie i stosunek 1: 1, który jest zgodny ze wzorem ZnS..
Nieruchomości
Kolor
Można to przedstawić na trzy sposoby:
-Wurtzyt z białymi i sześciokątnymi kryształami.
-Sfaleryt z szarobiałymi kryształami i sześciennymi kryształami.
-W postaci proszku o barwie od białej do szaro-białej lub żółtawej i sześciennych, żółtawych kryształów.
Temperatura topnienia
1700º C.
Rozpuszczalność w wodzie
Praktycznie nierozpuszczalny (0,00069 g / 100 ml w 18 ° C).
Rozpuszczalność
Nierozpuszczalny w zasadach, rozpuszczalny w rozcieńczonych kwasach mineralnych.
Gęstość
Sfaleryt 4,04 g / cm3 i wurtzyt 4,09 g / cm3.
Twardość
Ma twardość od 3 do 4 w skali Mohsa.
Stabilność
Gdy zawiera wodę, powoli utlenia się do siarczanu. W suchym środowisku jest stabilny.
Rozkład
Po podgrzaniu do wysokich temperatur wydziela toksyczne opary cynku i tlenków siarki.
Nomenklatura
Konfiguracja elektronowa Zn to [Ar] 3d104sdwa. Utrata dwóch elektronów z orbity 4s pozostaje kationem Zndwa+ z wypełnionymi orbitaliami d. Dlatego, ponieważ elektronicznie Zndwa+ jest dużo bardziej stabilny niż Zn+, ma tylko wartościowość +2.
W związku z tym pomija się go w nomenklaturze giełdowej, dodając jego wartościowość w nawiasach i cyframi rzymskimi: siarczek cynku (II).
Systematyczne i tradycyjne nazewnictwo
Ale są inne sposoby na wywołanie ZnS oprócz tego już podniesionego. W systematyce liczbę atomów każdego pierwiastka określa się za pomocą greckich liczników; z jedynym wyjątkiem elementu po prawej stronie, gdy jest tylko jeden. Tak więc ZnS nosi nazwę: małpasiarczek cynku (a nie monosiarczek cynku).
W odniesieniu do tradycyjnej nomenklatury cynk o pojedynczej wartościowości +2 jest dodawany przez dodanie przyrostka -ico. W konsekwencji jego tradycyjna nazwa to siarczek cynkui co.
Aplikacje
Jako pigmenty lub powłoki
-Sachtolith to biały pigment na bazie siarczku cynku. Stosowany w masach uszczelniających, kitach, uszczelniaczach, podkładach, farbach lateksowych i oznakowaniach.
Jego stosowanie w połączeniu z pigmentami pochłaniającymi światło ultrafioletowe, takimi jak mikro-tytan lub przezroczyste pigmenty tlenku żelaza, jest konieczne w przypadku pigmentów odpornych na warunki atmosferyczne.
-Gdy ZnS jest nakładany na farby lateksowe lub teksturowane, ma przedłużone działanie bakteriobójcze.
-Ze względu na dużą twardość i odporność na pękanie, erozję, deszcz lub kurz nadaje się do zewnętrznych okien na podczerwień lub w ramach samolotów.
-ZnS jest stosowany do powlekania wirników stosowanych w transporcie związków w celu zmniejszenia zużycia. Znajduje również zastosowanie w produkcji farb drukarskich, mas izolacyjnych, pigmentacji termoplastycznej, tworzyw sztucznych ognioodpornych oraz lamp elektroluminescencyjnych..
-Siarczek cynku może być przezroczysty i może być używany jako okno dla optyki widzialnej i optyki podczerwieni. Stosowany w urządzeniach noktowizyjnych, ekranach telewizyjnych, ekranach radarowych i powłokach fluorescencyjnych.
-Do produkcji paneli elektroluminescencyjnych stosowany jest ZnS z domieszkowaniem Cu. Jest również stosowany w napędzie rakietowym i grawimetrii.
Ze względu na fosforescencję
-Jego fosforescencja służy do barwienia wskazówek zegara, a tym samym do wyświetlania czasu w ciemności; także w farbie do zabawek, w znakach awaryjnych i ostrzeżeniach drogowych.
Fosforescencja umożliwia stosowanie siarczku cynku w lampach katodowych i ekranach rentgenowskich, aby świecić w ciemnych plamach. Kolor fosforescencji zależy od użytego aktywatora.
Półprzewodnik, fotokatalizator i katalizator
-Sfaleryt i wurtzyt to szerokopasmowe półprzewodniki szczelinowe. Sphalerite ma szczelinę pasmową 3,54 eV, podczas gdy wurtzyt ma szczelinę pasmową 3,91 eV.
-ZnS jest używany do przygotowania fotokatalizatora złożonego z CdS - ZnS / cyrkon - fosforanu tytanu do produkcji wodoru w świetle widzialnym.
-Działa jako katalizator degradacji zanieczyszczeń organicznych. Używany do przygotowania synchronizatora kolorów w lampach LED.
-Jego nanokryształy są używane do ultraczułego wykrywania białek. Na przykład, emitując światło z kropek kwantowych ZnS. Służy do przygotowania połączonego fotokatalizatora (CdS / ZnS) -TiO2 do produkcji elektrycznej poprzez fotoelektrokatalizę.
Bibliografia
- PubChem. (2018). Siarczek cynku. Zaczerpnięte z: pubchem.ncbi.nlm.nih.gov
- QuimiNet. (16 stycznia 2015). Biały pigment na bazie siarczku cynku. Odzyskany z: quiminet.com
- Wikipedia. (2018). Siarczek cynku. Zaczerpnięte z: en.wikipedia.org
- II-VI Wielka Brytania. (2015). Siarczek cynku (ZnS). Zaczerpnięte z: ii-vi.es
- Rob Toreki. (30 marca 2015). Struktura Zincblende (ZnS). Zaczerpnięte z: ilpi.com
- Chemia LibreTexts. (22 stycznia 2017). Struktura mieszanki cynkowej (ZnS). Zaczerpnięte z: chem.libretexts.org
- Reade. (2018). Siarczek cynku / Siarczek cynku (ZnS). Zaczerpnięte z: reade.com


Jeszcze bez komentarzy