
Charakterystyczne topoizomerazy, funkcje, typy i inhibitory
Plik topoizomerazy Są rodzajem enzymów izomerazy, które modyfikują topologię kwasu dezoksyrybonukleinowego (DNA), generując zarówno jego odwijanie, jak i zwijanie i superskręcenie.
Enzymy te odgrywają szczególną rolę w łagodzeniu naprężeń skrętnych w DNA, tak że mogą zachodzić ważne procesy, takie jak replikacja, transkrypcja DNA na informacyjny kwas rybonukleinowy (mRNA) i rekombinacja DNA..
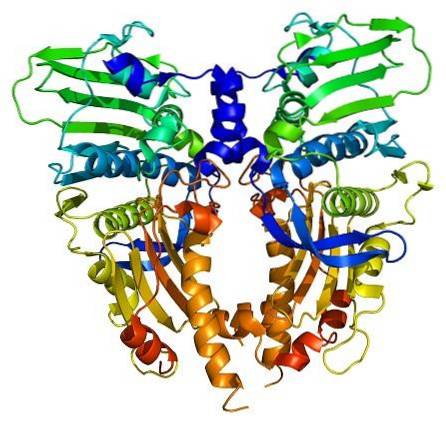
Enzymy topoizomerazy są obecne zarówno w komórkach eukariotycznych, jak i prokariotycznych. Jego istnienie zostało przewidziane przez naukowców Watsona i Cricka, oceniając ograniczenia, jakie przedstawiała struktura DNA, aby umożliwić dostęp do jego informacji (przechowywanych w jego sekwencji nukleotydów).
Aby zrozumieć funkcje topoizomerazy, należy uznać, że DNA ma stabilną strukturę podwójnej helisy, z nićmi nawiniętymi jedna na drugą..
Te liniowe łańcuchy składają się z 2-deoksyrybozy połączonej wiązaniami fosfodiestrowymi 5'-3 'i zasad azotowych wewnątrz nich, jak szczeble spiralnych schodów..
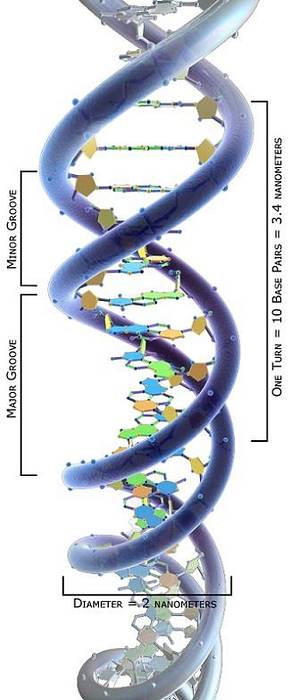
Topologiczne badanie cząsteczek DNA wykazało, że mogą one przyjmować różne konformacje w zależności od naprężenia skrętnego: od stanu zrelaksowanego do różnych stanów zwinięcia, które pozwalają na ich zagęszczenie..
Cząsteczki DNA o różnych konformacjach nazywane są topoizomerami. Zatem możemy wywnioskować, że topoizomerazy I i II mogą zwiększać lub zmniejszać naprężenie skrętne cząsteczek DNA, tworząc ich różne topoizomery..
Wśród możliwych topoizomerów DNA najczęstszą konformacją jest supersewka, która jest bardzo zwarta. Jednak podwójna helisa DNA musi być również rozwijana przez topoizomerazy podczas różnych procesów molekularnych..
Indeks artykułów
- 1 Funkcje
- 1.1 Ogólny mechanizm działania
- 1.2 Topoizomerazy i cykl komórkowy
- 2 Funkcje
- 2.1 Kompaktowe przechowywanie materiału genetycznego
- 2.2 Dostęp do informacji genetycznej
- 2.3 Regulacja ekspresji genów
- 2.4 Specyfika topoizomerazy II
- 3 Rodzaje topoizomerazy
- 3.1 -Topoizomerazy typu I
- 3.2 -Topoizomerazy typu II
- 3.3 -Ludzkie topoizomerazy
- 4 Inhibitory topoizomerazy
- 4.1 -Topoizomerazy jako cel ataku chemicznego
- 4.2 - Rodzaje zahamowania
- 4.3 - Leki będące inhibitorami topoizomerazy
- 5 Referencje
Charakterystyka
Ogólny mechanizm działania
Niektóre topoizomerazy mogą rozluźniać tylko ujemne superkręty DNA lub oba superskręty DNA: dodatnie i ujemne.
Jeśli kolisty dwuniciowy DNA jest rozwijany na swojej osi podłużnej i następuje skręt w lewo (zgodnie z ruchem wskazówek zegara), mówi się, że jest ujemnie superskręcony. Jeśli skręt jest zgodny z ruchem wskazówek zegara (przeciwnie do ruchu wskazówek zegara), jest pozytywnie przewinięty.

Zasadniczo topoizomerazy mogą:
-Ułatwienie przejścia nici DNA przez nacięcie w przeciwnej nici (topoizomeraza typu I).
-Ułatwienie przejścia pełnej podwójnej helisy przez samo cięcie lub przez cięcie do innej podwójnej helisy (topoizomeraza typu II).
Podsumowując, topoizomerazy działają poprzez rozszczepienie wiązań fosfodiestrowych w jednej lub obu niciach tworzących DNA. Następnie modyfikują stan zwinięcia pasm podwójnej helisy (topoizomeraza I) lub dwóch podwójnych helis (topoizomeraza II), aby ostatecznie związać lub ponownie związać odcięte końce.
Topoizomerazy i cykl komórkowy
Chociaż topoizomeraza I jest enzymem, który wykazuje większą aktywność podczas fazy S (synteza DNA), nie uważa się, że jest on zależny od fazy cyklu komórkowego.
Natomiast aktywność topoizomerazy II jest najbardziej aktywna w logarytmicznej fazie wzrostu komórek oraz w komórkach szybko rosnących guzów.
funkcje
Zmiana genów kodujących topoizomerazy jest śmiertelna dla komórek, co dowodzi znaczenia tych enzymów. Wśród procesów, w których uczestniczą topoizomerazy, są:
Kompaktowe przechowywanie materiału genetycznego
Topoizomerazy ułatwiają przechowywanie informacji genetycznej w zwarty sposób, ponieważ generują zwijanie i superskręcenie DNA, umożliwiając znalezienie dużej ilości informacji w stosunkowo małej objętości.
Dostęp do informacji genetycznej
Bez topoizomerazy i ich unikalnych cech dostęp do informacji przechowywanych w DNA byłby niemożliwy. Wynika to z faktu, że topoizomerazy okresowo uwalniają naprężenia skrętne powstające w podwójnej helisie DNA podczas jej rozwijania w procesach replikacji, transkrypcji i rekombinacji..
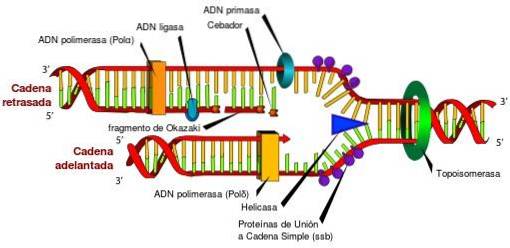
Jeśli naprężenie skrętne powstające podczas tych procesów nie zostanie uwolnione, może wystąpić wadliwa ekspresja genów, przerwanie kolistego DNA lub chromosomu, a nawet śmierć komórki.
Regulacja ekspresji genów
Zmiany konformacyjne (w trójwymiarowej strukturze) cząsteczki DNA odsłaniają określone regiony na zewnątrz, które mogą oddziaływać z białkami wiążącymi DNA. Białka te pełnią funkcję regulacyjną ekspresji genów (dodatnią lub ujemną).
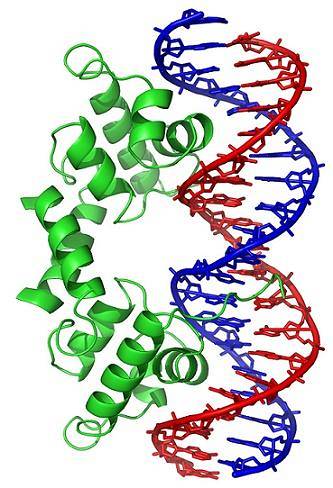
Zatem stan zwinięcia DNA, generowany przez działanie topoizomerazy, wpływa na regulację ekspresji genów.
Cechy szczególne topoizomerazy II
Topoizomeraza II jest niezbędna do tworzenia chromatyd, kondensacji i dekondensacji chromosomów oraz segregacji cząsteczek potomnych DNA podczas mitozy..
Enzym ten jest również białkiem strukturalnym i jednym z głównych składników macierzy jądra komórkowego podczas interfazy..
Rodzaje topoizomerazy
Istnieją dwa główne typy topoizomerazy w zależności od tego, czy są w stanie rozszczepić jedną czy dwie nici DNA.
-Topoizomerazy typu I.
Monomeryczny
Topoizomerazy typu I to monomery, które łagodzą ujemne i dodatnie superskręty, które są wytwarzane przez ruch spinki do włosów podczas transkrypcji oraz podczas procesów replikacji i rekombinacji genów..
Topoizomerazy typu I można podzielić na typ 1A i typ 1B. Te ostatnie występują u ludzi i są odpowiedzialne za rozluźnienie superskręconego DNA.
Tyrozyna w jej aktywnym miejscu
Topoizomeraza 1B (Top1B) składa się z 765 aminokwasów podzielonych na 4 określone domeny. Jedna z tych domen ma wysoce konserwatywny obszar zawierający miejsce aktywne tyrozyny (Tyr7233). Wszystkie topoizomerazy obecne w swoim miejscu aktywnym to tyrozyna, która odgrywa fundamentalną rolę w całym procesie katalitycznym.
Mechanizm akcji
Tyrozyna w miejscu aktywnym tworzy wiązanie kowalencyjne z 3'-fosforanowym końcem nici DNA, przecinając go i utrzymując przyczepiony do enzymu, jednocześnie przepuszczając inną nić DNA przez cięcie.
Przejście drugiej nici DNA przez rozszczepioną nić uzyskuje się dzięki transformacji konformacyjnej enzymu, która powoduje otwarcie podwójnej helisy DNA..
Następnie topoizomeraza I wraca do swojej początkowej konformacji i ponownie wiąże rozszczepione końce. Dzieje się to w procesie odwrotnym do rozpadu łańcucha DNA w miejscu katalitycznym enzymu. Wreszcie topoizomeraza uwalnia nić DNA.
Szybkość ligacji DNA jest wyższa niż szybkość wycinania, co zapewnia stabilność cząsteczki i integralność genomu..
Podsumowując, topoizomeraza typu I katalizuje:
- Rozszczepienie pasma.
- Przejście drugiego pasma przez dekolt.
- Podwiązanie rozszczepionych końców.
-Topoizomerazy typu II
Dimeric
Topoizomerazy typu II to dimeryczne enzymy, które rozszczepiają obie nici DNA, rozluźniając w ten sposób superkręty powstające podczas transkrypcji i innych procesów komórkowych.
Zależne od Mg++ i ATP
Enzymy te potrzebują magnezu (Mg++), a także potrzebują energii pochodzącej z rozpadu wiązania trójfosforanowego ATP, którą wykorzystują dzięki ATPazie.
Dwa miejsca aktywne z tyrozyną
Ludzkie topoizomerazy II są bardzo podobne do tych z drożdży (Saccharomyces cerevisiae), który składa się z dwóch monomerów (podfragmenty A i B). Każdy monomer ma domenę ATPazy, aw sub-fragmencie tyrozynę 782 w miejscu aktywnym, z którą może się wiązać DNA. Zatem dwie nici DNA mogą wiązać się z topoizomerazą II..
Mechanizm akcji
Mechanizm działania topoizomerazy II jest taki sam, jak ten opisany dla topoizomerazy I, biorąc pod uwagę, że dwie nici DNA są rozszczepione, a nie tylko jedna..
W miejscu aktywnym topoizomerazy II fragment podwójna helisa DNA, zwany „fragmentem G”. Ten fragment jest wycinany i utrzymywany razem w miejscu aktywnym przez wiązania kowalencyjne..
Następnie enzym pozwala na przejście innego fragmentu DNA, zwanego „fragmentem T”, przez rozszczepiony fragment „G”, dzięki zmianie konformacyjnej enzymu, która jest zależna od hydrolizy ATP.
Topoizomeraza II wiąże dwa końce „fragmentu G” i ostatecznie odzyskuje swój stan początkowy, uwalniając fragment „G”. Następnie DNA rozluźnia naprężenia skrętne, umożliwiając zachodzenie procesów replikacji i transkrypcji..
-Ludzkie topoizomerazy
Genom ludzki ma pięć topoizomerazy: top1, top3α, top3β (typu I); i top2α, top2β (typu II). Najbardziej odpowiednimi ludzkimi topoizomerazami są top1 (topoizomeraza typu IB) i 2α (topoizomeraza typu II).
Inhibitory topoizomerazy
-Topoizomerazy jako cel ataku chemicznego
Ponieważ procesy katalizowane przez topoizomerazy są niezbędne do przetrwania komórek, enzymy te są dobrym celem ataku na komórki złośliwe. Z tego powodu topoizomerazy są uważane za ważne w leczeniu wielu chorób człowieka..
Leki, które oddziałują z topoizomerazami, są obecnie szeroko badane jako substancje chemioterapeutyczne przeciwko komórkom rakowym (w różnych narządach ciała) i mikroorganizmom chorobotwórczym..
-Rodzaje zahamowania
Leki hamujące aktywność topoizomerazy mogą:
- Wciśnięty w DNA.
- Wpływają na enzym topoizomerazę.
- Interkalacja w cząsteczce blisko miejsca aktywnego enzymu, podczas gdy kompleks DNA-topoizomeraza jest stabilizowany.
Stabilizacja przejściowego kompleksu, który jest tworzony przez wiązanie DNA z tyrozyną w miejscu katalitycznym enzymu, zapobiega wiązaniu rozszczepionych fragmentów, co może prowadzić do śmierci komórki.
-Leki z grupy inhibitorów topoizomerazy
Następujące związki hamują topoizomerazy.
Antybiotyki przeciwnowotworowe
Antybiotyki są stosowane przeciwko rakowi, ponieważ zapobiegają wzrostowi komórek nowotworowych, zwykle poprzez ingerowanie w ich DNA. Są one często nazywane antybiotykami przeciwnowotworowymi (rakowymi). Na przykład aktynomycyna D wpływa na topoizomerazę II i jest stosowana w nowotworach Wilmsa u dzieci i mięsakach prążkowanokomórkowych.
Antracykliny
Antracykliny należą do antybiotyków, jednych z najskuteczniejszych leków przeciwnowotworowych o najszerszym spektrum działania. Są stosowane w leczeniu raka płuc, jajników, macicy, żołądka, pęcherza, piersi, białaczki i chłoniaków. Wiadomo, że wpływa na topoizomerazę II poprzez interkalację w DNA.
Pierwsza antracyklina wyizolowana z aktynobakterii (Streptomyces peucetius) była daunorubicyna. Później doksorubicynę zsyntetyzowano w laboratorium, a obecnie stosuje się również epirubicynę i idarubicynę.
Antrachinony
Antrachinony lub antracenediony są związkami pochodzącymi z antracenu, podobnie jak antracykliny, które wpływają na aktywność topoizomerazy II poprzez interkalację w DNA. Są stosowane w przypadku raka piersi z przerzutami, chłoniaka nieziarniczego (NHL) i białaczki..
Leki te znaleziono w pigmentach niektórych owadów, roślin (frangula, senes, rabarbar), porostach i grzybach; a także hoelit, który jest naturalnym minerałem. W zależności od dawki mogą być rakotwórcze.
Wśród tych związków jest mitoksantron i jego analog, lozoksantron. Zapobiegają one proliferacji złośliwych komórek nowotworowych, nieodwracalnie wiążąc się z DNA.
Epidofilotoksyny
Podofilotoksyny, takie jak epidofilotoksyny (VP-16) i tenipozyd (VM-26), tworzą kompleks z topoizomerazą II. Stosuje się je m.in. w leczeniu raka płuc, jąder, białaczki, chłoniaków, raka jajnika, raka piersi oraz złośliwych guzów wewnątrzczaszkowych. Są izolowane od roślin Podophyllum notatum Y P. peltatum.
Analogi kamptotecyny
Kampoteciny to związki hamujące topoizomerazę I, w tym irynotekan, topotekan i diflomotekan..
Związki te są stosowane przeciwko rakowi okrężnicy, płuc i piersi i są pozyskiwane w sposób naturalny z kory i liści gatunków nadrzewnych. Camptotheca acuminata chińskich gzymsów i Tybetu.
Naturalne zahamowanie
Strukturalne zmiany topoizomerazy I i II mogą również zachodzić całkowicie naturalnie. Może się to zdarzyć podczas niektórych wydarzeń, które wpływają na proces katalityczny.
Te zmiany obejmują tworzenie dimerów pirymidynowych, niedopasowanie zasad azotowych i inne zdarzenia spowodowane stresem oksydacyjnym..
Bibliografia
- Anderson, H. i Roberge, M. (1992). DNA topoizomeraza II: przegląd jej udziału w strukturze chromosomu, replikacji DNA, transkrypcji i mitozie. Cell Biology International Reports, 16 (8): 717–724. doi: 10,1016 / s0309-1651 (05) 80016-5
- Chhatriwala, H., Jafri, N., & Salgia, R. (2006). Przegląd hamowania topoizomerazy w raku płuc. Cancer Biology & Therapy, 5 (12): 1600–1607. doi: 10.4161 / cbt.5.12.3546
- Ho, Y.-P., Au-Yeung, S. C. F., & To, K. K. W. (2003). Środki przeciwnowotworowe na bazie platyny: innowacyjne strategie projektowania i perspektywy biologiczne. Medicinal Research Reviews, 23 (5): 633-655. doi: 10.1002 / med.10038
- Li, T.-K. i Liu, L. F. (2001). Śmierć komórek guza indukowana przez leki celowane w topoizomerazę. Annual Review of Pharmacology and Toxicology, 41 (1): 53–77. doi: 10.1146 / annurev.pharmtox.41.1.53
- Liu, L. F. (1994). DNA Topoizomerazy: leki ukierunkowane na topoizomerazę. Academic Press. pp 307
- Osheroff, N. i Bjornsti, M. (2001). Topoizomeraza DNA. Enzymologia i leki. Vol. II. Humana Press. pp 329.
- Rothenberg, M. L. (1997). Inhibitory topoizomerazy I: przegląd i aktualizacja. Annals of Oncology, 8 (9), 837-855. doi: 10.1023 / a: 1008270717294
- Ryan B. (2009, 14 grudnia). Topoizomeraza 1 i 2. [plik wideo]. Odzyskany z youtube.com
Jeszcze bez komentarzy