
50 przykładów kwasów i zasad

Są setki przykłady kwasów i zasad które można znaleźć we wszystkich gałęziach chemii, ale jako całość są podzielone na dwie duże rodziny: nieorganiczną i organiczną. Kwasy nieorganiczne są zwykle znane jako kwasy mineralne, które charakteryzują się szczególnie silnym działaniem w porównaniu z kwasami organicznymi..
Kwasy i zasady są rozumiane jako substancje, które mają odpowiednio kwaśny lub mydlany smak. Oba są żrące, chociaż słowo „żrący” jest często używane w odniesieniu do mocnych zasad. Konkluzja: palą i korodują skórę po dotknięciu. Jego cechy charakterystyczne dla rozpuszczających się mediów kierowały serią definicji w całej historii..
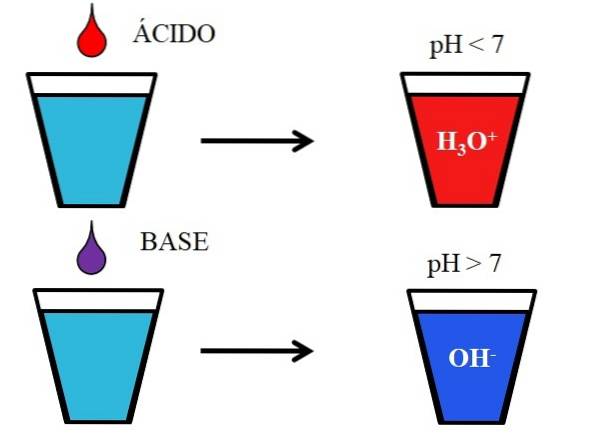
Poniższy rysunek przedstawia ogólne zachowanie kwasów i zasad po ich dodaniu lub rozpuszczeniu w szklance wody. Kwasy wytwarzają roztwory o wartości pH poniżej 7 z powodu jonów hydroniowych, H3LUB+; podczas gdy zasady tworzą roztwory o pH powyżej 7 ze względu na jony hydroksylowe (lub hydroksylowe), OH-.
Jeśli dodamy do szkła kwas solny, HCl (czerwona kropla), pojawią się jony H.3LUB+ i Cl- uwodniony. Z drugiej strony, jeśli powtórzymy eksperyment z wodorotlenkiem sodu, NaOH (fioletowa kropla), będziemy mieli jony OH- i Na+.
Indeks artykułów
- 1. Definicje
- 1.1 Arrhenius
- 1.2 Bronsted-Lowry
- 1.3 Lewis
- 2 Przykłady kwasów
- 3 Przykłady podstaw
- 4 Odnośniki
Definicje

Coraz bardziej badane i rozumiane właściwości kwasów i zasad doprowadziły do powstania więcej niż jednej definicji tych związków chemicznych. Wśród tych definicji mamy Arrheniusa, Bronsteda-Lowry'ego i wreszcie Lewisa. Przed zacytowaniem przykładów konieczne jest wyjaśnienie tego.
Arrhenius
Według Arrheniusa kwasy i zasady to takie, które po rozpuszczeniu w wodzie wytwarzają jony H.3LUB+ lub OH-, odpowiednio. Oznacza to, że obraz już reprezentuje tę definicję. Jednak sam w sobie zaniedbuje niektóre kwasy lub zasady zbyt słabe do produkcji takich jonów. Tutaj pojawia się definicja Bronsteda-Lowry'ego..
Bronsted-Lowry
Kwasy Bronsteda-Lowry'ego to te, które mogą oddawać jony H.+, a podstawy to te, które akceptują te H.+. Jeśli kwas bardzo łatwo oddaje swój H+, oznacza, że jest to mocny kwas. To samo dzieje się z podstawami, ale akceptując H.+.
Mamy więc mocne lub słabe kwasy i zasady, a ich siły są mierzone w różnych rozpuszczalnikach; szczególnie w wodzie, na podstawie której ustalane są znane jednostki pH (od 0 do 14).
Dlatego silny kwas HA w pełni odda Twój H.+ na wodę w reakcji typu:
HA + HdwaO => A- + H.3LUB+
Dokąd- jest sprzężoną bazą HA. Stąd pochodzi H.3LUB+ obecny w szkle z roztworem kwasu.
W międzyczasie słaba zasada B deprotonuje wodę, aby uzyskać odpowiedni poziom H.+:
B + HdwaLUB <=> HB + OH-
Gdzie HB jest sprzężonym kwasem B. Jest to przypadek amoniaku, NH3:
NH3 + H.dwaLUB <=> NH4+ + O-
Bardzo silna zasada może bezpośrednio przekazywać jony OH- bez konieczności reagowania z wodą; podobnie jak NaOH.
Chwytak
Wreszcie, kwasy Lewisa to te, które uzyskują lub przyjmują elektrony, a zasady Lewisa to te, które przekazują lub tracą elektrony..
Na przykład baza NH Bronsted-Lowry3 Jest to również zasada Lewisa, ponieważ atom azotu przyjmuje H+ przekazując swoją parę wolnych elektronów (H.3N: H.+). Dlatego te trzy definicje nie są ze sobą sprzeczne, ale raczej przeplatają się i pomagają w badaniu kwasowości i zasadowości w szerszym spektrum związków chemicznych..
Przykłady kwasów
Po wyjaśnieniu definicji poniżej wymieniona zostanie seria kwasów wraz z ich odpowiednimi wzorami i nazwami:
-HF: kwas fluorowodorowy
-HBr: kwas bromowodorowy
-HI: kwas jodowodorowy
-H.dwaS: siarkowodór
-H.dwaSe: kwas selenowodorowy
-H.dwaHerbata: kwas tellurowodorowy
Są to kwasy dwuskładnikowe, zwane także wodorokwasami, do których należy wspomniany wyżej kwas solny, HCl.
-HNO3: kwas azotowy
-HNOdwa: kwas azotowy
-HNO: kwas pod azotawy
-H.dwaWSPÓŁ3: kwas węglowy
-H.dwaWSPÓŁdwa: kwas węglowy, który właściwie jest lepiej znany pod nazwą kwasu mrówkowego, HCOOH, najprostszy kwas organiczny ze wszystkich
-H.3PO4: Kwas fosforowy
-H.3PO3 lub H.dwa[HPO3]: kwas fosforawy, z wiązaniem H-P
-H.3POdwa lub H [HdwaPOdwa]: kwas podfosforawy, z dwoma wiązaniami H-P
-H.dwapołudniowy zachód4: Kwas Siarkowy
-H.dwapołudniowy zachód3: kwas siarkowy
-H.dwaSdwaLUB7: kwas siarkowy
-HIO4: kwas nadjodowy
-HIO3: kwas jodowy
-HIOdwa: kwas jodowy
-HIO: kwas hipojodowy
-H.dwaCrO4: kwas chromowy
-HMnO4: kwas manganowy
-CH3COOH: kwas octowy (ocet)
-CH3południowy zachód3H: kwas metanosulfonowy
Wszystkie te kwasy, z wyjątkiem kwasów mrówkowego i dwóch ostatnich, są znane jako kwasy oksydowe lub trójskładnikowe..
Inne:
-AlCl3: chlorek glinu
-FeCl3: Chlorek żelaza
-BF3: trifluorek boru
-Kationy metaliczne rozpuszczone w wodzie
-Carbocations
-H (CHBjedenaścieCljedenaście): superkwasowy karboran
- FSO3H: kwas fluorosulfonowy
- HSbF6: kwas fluoroantymonowy
- FSO3H SbF5: magiczny kwas
Ostatnie cztery przykłady składają się na przerażające superkwasy; związki zdolne do rozpadu prawie każdego materiału przez samo dotknięcie. AlCl3 jest przykładem kwasu Lewisa, ponieważ metalowy środek aluminium jest w stanie przyjmować elektrony ze względu na swój niedobór elektroniki (nie uzupełnia oktetu walencyjnego).
Przykłady podstaw
Wśród zasad nieorganicznych mamy wodorotlenki metali, takie jak wodorotlenek sodu, i niektóre wodorki molekularne, takie jak wspomniany już amoniak. Oto inne przykłady baz:
-KOH: wodorotlenek potasu
-LiOH: wodorotlenek litu
-RbOH: wodorotlenek rubidu
-CsOH: wodorotlenek cezu
-FrOH: wodorotlenek franu
-Be (OH)dwa: wodorotlenek berylu
-Mg (OH)dwa: wodorotlenek magnezu
-Ca (OH)dwa: wodorotlenek wapnia
-Sr (OH)dwa: wodorotlenek strontu
-Ba (OH)dwa: wodorotlenek baru
-Ra (OH)dwa: wodorotlenek radu
-Fe (OH)dwa: wodorotlenek żelazawy
-Fe (OH)3: wodorotlenek żelazowy
-Al (OH)3: wodorotlenek glinu
-Pb (OH)4: wodorotlenek ołowiu
-Zn (OH)dwa: wodorotlenek cynku
-Cd (OH)dwa: wodorotlenek kadmu
-Cu (OH)dwa: wodorotlenek miedziowy
-Ti (OH)4: wodorotlenek tytanu
-PH3: fosfina
-Popiół3: arsynowy
-NaNHdwa: amidek sodu
- do5H.5N: pirydyna
-(CH3) N: trimetyloamina
- do6H.5NHdwa: fenyloamina lub anilina
-NaH: wodorek sodu
-KH: wodorek potasu
-Karbany
-Li3N: azotek litu
-Alkoholany
-[(CH3)dwaCH]dwaNLi: diizopropyloamidek litu
-Anion dietynylobenzenu: C6H.4do4dwa- (najsilniejsza dotychczas znana podstawa)
Bibliografia
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Naomi Hennah. (10 października 2018). Jak uczyć kwasów, zasad i soli. Odzyskany z: edu.rsc.org
- Helmenstine, dr Anne Marie (31 sierpnia 2019). Formuły wspólnych kwasów i zasad. Odzyskany z: thinkco.com
- David Wood. (2019). Porównanie popularnych kwasów i zasad. Nauka. Odzyskany z: study.com
- Ross Pomeroy. (23 sierpnia 2013). Najsilniejsze kwasy świata: jak ogień i lód. Odzyskany z: realclearscience.com
- Wikipedia. (2019). Dianion dietynylobenzenu. Odzyskane z: en.wikipedia.org



Jeszcze bez komentarzy