
Absorbancja, co to jest, przykłady i rozwiązane ćwiczenia
Plik absorbancja jest logarytmem ze znakiem ujemnym ilorazu natężenia światła wychodzącego i natężenia światła padającego na próbkę przeświecającego roztworu, który został oświetlony światłem monochromatycznym. Ten iloraz to przepuszczalność.
Nazywa się fizyczny proces przechodzenia światła przez próbkę transmisja światła, a absorbancja jest tego miarą. W związku z tym absorbancja staje się najmniejszym logarytmem transmitancji i stanowi ważne dane do określenia stężenia próbki, która jest na ogół rozpuszczona w rozpuszczalniku, takim jak woda, alkohol lub jakikolwiek inny..
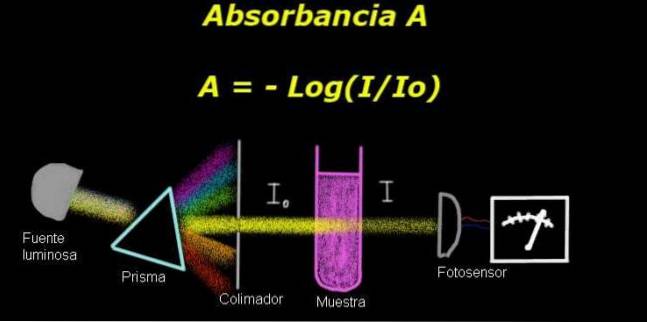
Do pomiaru absorbancji potrzebne jest urządzenie o nazwie elektrofotometr, którym mierzony jest prąd proporcjonalny do natężenia światła padającego na jego powierzchnię.
Podczas obliczania transmitancji, zwykle najpierw mierzy się sygnał natężenia odpowiadający samemu rozpuszczalnikowi, a ten wynik jest zapisywany jako Io.
Następnie rozpuszczoną próbkę umieszcza się w rozpuszczalniku w tych samych warunkach oświetleniowych. Sygnał mierzony przez elektrofotometr oznaczono jako ja, co pozwala obliczyć transmitancję T według następującego wzoru:
T = I / Ilub
Jest to wielkość bezwymiarowa. Plik absorbancja A. jest zatem wyrażona jako:
A = - log (T) = - log (I / Ilub)
Indeks artykułów
- 1 Absorbancja i chłonność molowa
- 1.1 Prawo Beera-Lamberta
- 2 Przykłady
- 2.1 Przykład 1
- 2.2 Przykład 2
- 3 ćwiczenia rozwiązane
- 3.1 Ćwiczenie 1
- 3.2 Ćwiczenie 2
- 3.3 Ćwiczenie 3
- 4 Odnośniki
Absorbancja i chłonność molowa
Cząsteczki tworzące substancję chemiczną są zdolne do pochłaniania światła, a jedną z miar tego jest właśnie absorbancja. Jest wynikiem interakcji między fotonami i elektronami molekularnymi.
Dlatego jest to wielkość, która będzie zależeć od gęstości lub stężenia cząsteczek tworzących próbkę, a także od ścieżki optycznej lub odległości pokonywanej przez światło..
Dane eksperymentalne wskazują, że absorbancja DO jest liniowo proporcjonalny do stężenia do i na odległość re przemierzane przez światło. Aby obliczyć to na podstawie tych parametrów, można ustalić następujący wzór:
A = ε⋅C⋅d
W powyższym wzorze, ε jest stałą proporcjonalności znaną jako chłonność molowa.
Absorpcja molowa zależy od rodzaju substancji i długości fali, przy której jest mierzona absorbancja. Plik chłonność molowa jest również wrażliwy na temperaturę i pH próbki.
Prawo Beera-Lamberta
Ten związek między absorbancją, chłonnością, stężeniem i odległością grubości ścieżki, po której podąża światło w próbce, jest znany jako prawo Beera-Lamberta..

Oto kilka przykładów, jak z niego korzystać.
Przykłady
Przykład 1
Podczas eksperymentu próbkę oświetla się czerwonym światłem lasera helowo-neonowego o długości fali 633 nm. Elektrofotometr mierzy 30 mV, gdy światło lasera pada bezpośrednio i 10 mV, gdy przechodzi przez próbkę..
W tym przypadku przepuszczalność wynosi:
T = I / Io = 10 mV / 30 mV = ⅓.
A absorbancja wynosi:
A = - log (⅓) = log (3) = 0,48
Przykład 2
Jeśli ta sama substancja jest umieszczona w pojemniku, który jest o połowę mniejszy niż ten użyty w przykładzie 1, należy określić, ile będzie oznaczał elektrofotometr, gdy światło lasera helowo-neonowego przejdzie przez próbkę..
Należy wziąć pod uwagę, że jeśli grubość zmniejszy się o połowę, to absorbancja proporcjonalna do grubości optycznej zmniejszy się o połowę, czyli A = 0,28. Przepuszczalność T zostanie określona przez następującą zależność:
T = 10-A = 10 ^ (- 0,28) = 0,53
Elektrofotometr odczyta 0,53 * 30 mV = 15,74 mV.
Rozwiązane ćwiczenia
Ćwiczenie 1
Chcemy określić molową absorpcję pewnego zastrzeżonego związku, który jest w roztworze. W tym celu roztwór naświetla się światłem z lampy sodowej 589 nm. Próbka zostanie umieszczona w uchwycie na próbki o grubości 1,50 cm.
Punktem wyjścia jest roztwór o stężeniu 4,00 × 10 ^ -4 moli na litr i mierzona jest transmitancja, uzyskując 0,06. Korzystając z tych danych, określ molową absorpcję próbki..
Rozwiązanie
Najpierw określa się absorbancję, którą definiuje się jako najmniejszy logarytm dziesiętny transmitancji:
A = - log (T)
A = - log (0,06) = 1,22
Następnie stosuje się prawo Lamberta-Beera, które określa zależność między absorbancją, absorpcją molową, stężeniem i długością optyczną:
A = ε⋅C⋅d
Rozpatrując absorpcję molową, otrzymujemy następującą zależność:
ε = A / (C⋅d)
podstawiając podane wartości mamy:
ε = 1,22 / (4,00 × 10 ^ -4 M⋅1,5 cm) = 2030 (M⋅cm) ^ - 1
Powyższy wynik został zaokrąglony do trzech cyfr znaczących.
Ćwiczenie 2
W celu poprawienia precyzji i określenia błędu pomiaru chłonności molowej próbki w ćwiczeniu 1 próbkę rozcieńcza się sukcesywnie do połowy stężenia i każdorazowo mierzy transmitancję..
Zaczynając od Co = 4 × 10 ^ -4 M z transmitancją T = 0,06, otrzymujemy następującą sekwencję danych dla transmitancji i absorbancji obliczonej z transmitancji:
Co / 1 -> 0,06 -> 1,22
Co / 2-> 0,25-> 0,60
Co / 4-> 0,50 -> 0,30
Co / 8 -> 0,71 -> 0,15
Co / 16 -> 0,83 -> 0,08
Co / 32-> 0,93-> 0,03
Co / 64-> 0,95-> 0,02
Co / 128-> 0,98-> 0,01
Co / 256-> 0,99-> 0,00
Z tymi danymi wykonaj:
a) Wykres absorbancji w funkcji stężenia.
b) Liniowe dopasowanie danych i wyznaczenie nachylenia.
c) Z uzyskanego nachylenia obliczyć molową absorpcję.
Rozwiązanie
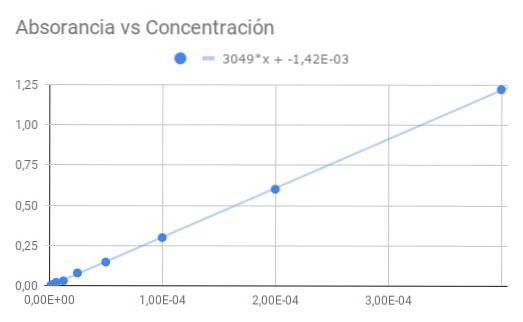
Otrzymane nachylenie jest iloczynem absorpcji molowej i odległości optycznej, więc dzieląc nachylenie przez długość 1,5 cm otrzymujemy absorpcję molową
ε = 3049 / 1,50 = 2033 (M⋅cm) ^ - 1
Ćwiczenie 3
Z danymi z ćwiczenia 2:
a) Obliczyć chłonność dla każdego z danych.
b) Określić średnią wartość absorpcji molowej, jej odchylenie standardowe i błąd statystyczny związany ze średnią..
Rozwiązanie
Absorpcję molową oblicza się dla każdego z badanych stężeń. Pamiętaj, że warunki oświetleniowe i odległość optyczna pozostają stałe.
Wyniki dla absorpcji molowej są następujące:
2033, 2007, 2007, 1983, 2158, 1681, 2376, 1872, 1862 w jednostkach 1 / (M * cm).
Z tych wyników możemy wziąć średnią wartość:
<ε> = 1998 (M * cm) ^ - 1
Z odchyleniem standardowym: 184 (M * cm) ^ - 1
Średni błąd to odchylenie standardowe podzielone przez pierwiastek kwadratowy z liczby danych, czyli:
Δ<ε>= 184/9 ^ 0,5 = 60 (M * cm) ^ - 1
Ostatecznie stwierdza się, że opatentowana substancja ma molową absorpcję przy częstotliwości 589 nm wytwarzaną przez lampę sodową:
<ε> = (2000 ± 60) (M * cm) ^ - 1
Bibliografia
- Atkins, P. 1999. Physical Chemistry. Wydania Omega. 460-462.
- Przewodnik. Przepuszczalność i absorbancja. Odzyskany z: quimica.laguia2000.com
- Toksykologia środowiskowa. Przepuszczalność, absorbancja i prawo Lamberta. Odzyskany z: repositorio.innovacionumh.es
- Fizyczna przygoda. Absorbancja i przepuszczalność. Odzyskany z: rpfisica.blogspot.com
- Spektrofotometria. Źródło: chem.libretexts.org
- Toksykologia środowiskowa. Przepuszczalność, absorbancja i prawo Lamberta. Odzyskany z: repositorio.innovacionumh.es
- Wikipedia. Absorbancja Odzyskane z: wikipedia.com
- Wikipedia. Spektrofotometria. Odzyskane z: wikipedia.com



Jeszcze bez komentarzy