
Struktura octanu etylu, właściwości, synteza, zastosowania
Plik octan etylu lub etanian etylu (Nazwa IUPAC) to związek organiczny, którego wzór chemiczny to CH3COOCdwaH.5. Składa się z estru, w którym składnik alkoholowy pochodzi z etanolu, a składnik kwasu karboksylowego z kwasu octowego..
W normalnych warunkach temperatury i ciśnienia jest cieczą o przyjemnym owocowym aromacie. Ta właściwość doskonale harmonizuje z tym, czego oczekuje się od estru; co jest w rzeczywistości chemiczną naturą octanu etylu. Z tego powodu znajduje zastosowanie w produktach spożywczych i napojach alkoholowych..

Górne zdjęcie przedstawia szkieletową strukturę octanu etylu. Zwróć uwagę po lewej stronie na składnik kwasu karboksylowego, a po prawej na składnik alkoholowy. Ze strukturalnego punktu widzenia można oczekiwać, że związek ten będzie zachowywał się jak hybryda octu i alkoholu; jednak wykazuje swoje własne właściwości.
To tutaj takie hybrydy zwane estrami wyróżniają się odmiennością. Octan etylu nie może reagować jako kwas ani nie może być odwodniony z powodu braku grupy OH. Zamiast tego ulega zasadowej hydrolizie w obecności mocnej zasady, takiej jak wodorotlenek sodu, NaOH.
Ta reakcja hydrolizy jest wykorzystywana w laboratoriach dydaktycznych do eksperymentów kinetyki chemicznej; gdzie reakcja jest również drugiego rzędu. Gdy zachodzi hydroliza, etanian etylu wraca praktycznie do swoich początkowych składników: kwasu (deprotonowanego NaOH) i alkoholu.
W jego szkielecie strukturalnym zaobserwowano, że atomy wodoru dominują nad atomami tlenu. Wpływa to na ich zdolność do interakcji z gatunkami, które nie są tak polarne jak tłuszcze. Podobnie jest używany do rozpuszczania związków, takich jak żywice, barwniki i ogólnie organiczne ciała stałe..
Długotrwała ekspozycja na ten płyn, pomimo przyjemnego aromatu, ma negatywny wpływ (podobnie jak prawie wszystkie związki chemiczne) na organizm..
Indeks artykułów
- 1 Struktura octanu etylu
- 1.1 Brak atomów będących donorami wiązań wodorowych
- 2 Właściwości fizyczne i chemiczne
- 2.1 Nazwy
- 2.2 Wzór cząsteczkowy
- 2.3 Masa cząsteczkowa
- 2.4 Opis fizyczny
- 2.5 Kolor
- 2.6 Zapach
- 2.7 Smak
- 2.8 Próg zapachu
- 2.9 Temperatura wrzenia
- 2.10 Temperatura topnienia
- 2.11 Rozpuszczalność w wodzie
- 2.12 Rozpuszczalność w rozpuszczalnikach organicznych
- 2.13 Gęstość
- 2.14 Gęstość par
- 2.15 Stabilność
- 2.16 Prężność par
- 2.17 Lepkość
- 2.18 Ciepło spalania
- 2.19 Ciepło parowania
- 2.20 Napięcie powierzchniowe
- 2.21 Współczynnik załamania światła
- 2.22 Temperatura przechowywania
- 2,23 pKa
- 3 Synteza
- 3.1 Reakcja Fishera
- 3.2 Reakcja Tiszczenki
- 3.3 Inne metody
- 4 Zastosowania
- 4.1 Rozpuszczalnik
- 4.2 Sztuczne aromaty
- 4.3 Analityka
- 4.4 Syntezy organiczne
- 4.5 Chromatografia
- 4.6 Entomology
- 5 Ryzyka
- 6 Odnośniki
Struktura octanu etylu
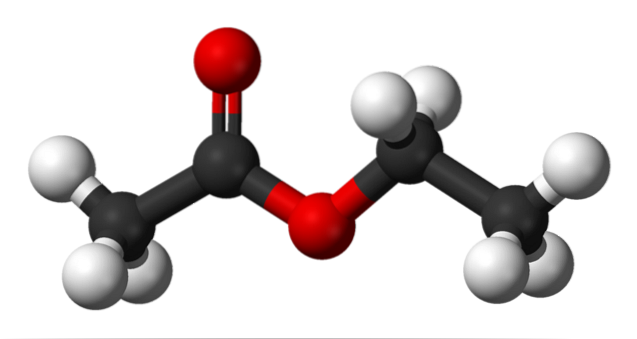
Górny obraz przedstawia strukturę octanu etylu z modelem kulek i słupków. W tym modelu atomy tlenu są zaznaczone czerwonymi kulkami; po jej lewej stronie znajduje się frakcja pochodząca z kwasu, a po prawej frakcja pochodząca z alkoholu (grupa alkoksylowa, -OR).
Grupę karbonylową widać po wiązaniu C = O (podwójne słupki). Struktura wokół tej grupy i sąsiedniego tlenu jest płaska, ze względu na delokalizację ładunku w wyniku rezonansu między obydwoma tlenami; fakt, który wyjaśnia stosunkowo niską kwasowość wodorów α (tych z grupy -CH3, powiązany z C = O).
Obracając dwa swoje wiązania, cząsteczka bezpośrednio faworyzuje sposób, w jaki oddziałuje z innymi cząsteczkami. Obecność dwóch atomów tlenu i asymetria w strukturze nadają mu stały moment dipolowy; który z kolei jest odpowiedzialny za ich interakcje dipol-dipol.
Na przykład gęstość elektronów jest wyższa w pobliżu dwóch atomów tlenu, znacznie zmniejszając się w grupie -CH.3, i stopniowo w grupie OCHdwaCH3.
W wyniku tych interakcji cząsteczki octanu etylu tworzą w normalnych warunkach ciecz o bardzo wysokiej temperaturze wrzenia (77ºC)..
Brak atomów będących donorami wiązań wodorowych
Jeśli przyjrzysz się uważnie strukturze, zauważysz brak atomu zdolnego do oddania wiązania wodorowego. Jednak atomy tlenu są takimi akceptorami, a ze względu na octan etylu jest on bardzo dobrze rozpuszczalny w wodzie i oddziałuje w znacznym stopniu ze związkami polarnymi i donorami wiązań wodorowych (takimi jak cukry)..
Pozwala to również na doskonałą interakcję z etanolem; powód, dla którego nie brakuje jej obecności w napojach alkoholowych.
Z drugiej strony jego grupa alkoksylowa sprawia, że jest on zdolny do interakcji z niektórymi związkami niepolarnymi, takimi jak chloroform, CH3Cl.
Fizyczne i chemiczne właściwości
Nazwy
-Octan etylu
-Etanian etylu
-Ester etylooctowy
-Acetoksyetan
Formuła molekularna
do4H.8LUBdwa lub CH3COOCdwaH.5
Waga molekularna
88,106 g / mol.
Opis fizyczny
Przejrzysty, bezbarwny płyn.
Kolor
Bezbarwna ciecz.
Zapach
Charakterystyczny dla eterów, podobny do zapachu ananasa.
Smak
Przyjemny po rozcieńczeniu, nadaje piwu owocowy posmak.
Próg zapachu
3,9 ppm. 0,0196 mg / m3 (słaby zapach); 665 mg / m23 (silny zapach).
Zapach wykrywalny przy 7-50 ppm (średnio = 8 ppm).
Temperatura wrzenia
171ºF do 760mmHg (77,1ºC).
Temperatura topnienia
-118,5ºF (-83,8ºC).
Rozpuszczalność w wodzie
80 g / l.
Rozpuszczalność w rozpuszczalnikach organicznych
Mieszalny z etanolem i eterem etylowym. Bardzo dobrze rozpuszczalny w acetonie i benzenie. Mieszalny również z chloroformem, nielotnymi i lotnymi olejami, a także z utlenionymi i chlorowanymi rozpuszczalnikami.
Gęstość
0,9003 g / cm3.
Gęstość pary
3,04 (stosunek powietrze: 1).
Stabilność
Rozkłada się powoli wraz z wilgocią; niekompatybilny z różnymi tworzywami sztucznymi i silnymi utleniaczami. Mieszanie z wodą może grozić wybuchem.
Ciśnienie pary
93,2 mmHg w 25 ° C
Lepkość
0,423 mPoise przy 25 ºC.
Ciepło spalania
2238,1 kJ / mol.
Ciepło parowania
35,60 kJ / mol w 25 ºC.
Napięcie powierzchniowe
24 dyn / cm w 20 ° C.
Współczynnik załamania światła
1373 przy 20 ° C / D.
Temperatura przechowywania
2 - 8 ºC.
pKa
16 - 18 w 25 ºC.
Synteza
Reakcja Fishera
Octan etylu jest syntetyzowany na skalę przemysłową w reakcji Fishera, w której etanol jest estryfikowany kwasem octowym. Reakcję prowadzi się w temperaturze pokojowej.
CH3CHdwaOH + CH3COOH <=> CH3COOCHdwaCH3 + H.dwaLUB
Reakcja jest przyspieszana przez katalizę kwasową. Równowaga przesuwa się w prawo, to znaczy w kierunku produkcji octanu etylu, poprzez usuwanie wody; zgodnie z Prawem Czynu Masowego.
Reakcja Tiszczenki
Octan etylu jest również wytwarzany przemysłowo przy użyciu reakcji Tiszczenki, polegającej na sprzęganiu dwóch równoważników aldehydu octowego z użyciem alkoholanu jako katalizatora..
2 CH3CHO => CH3COOCHdwaCH3
Inne metody
-Octan etylu syntetyzowany jest jako produkt uboczny utleniania butanu do kwasu octowego w reakcji prowadzonej w temperaturze 175ºC i pod ciśnieniem 50 atm. Jest stosowany jako katalizator jonów kobaltu i chromu.
-Octan etylu jest produktem ubocznym etanolizy polioctanu winylu do polialkoholu winylowego.
-Octan etylu jest również wytwarzany w przemyśle poprzez odwodornienie etanolu, katalizowanie reakcji poprzez zastosowanie miedzi w wysokiej temperaturze, ale poniżej 250 ° C..
Aplikacje
Rozpuszczalnik
Octan etylu jest używany jako rozpuszczalnik i rozcieńczalnik, używany do czyszczenia obwodów drukowanych. Jest stosowany jako rozpuszczalnik przy produkcji modyfikowanego ekstraktu chmielu oraz przy dekofeinacji liści kawy i herbaty. Znajduje zastosowanie w tuszach używanych do znakowania owoców i warzyw.
Octan etylu jest stosowany w przemyśle tekstylnym jako środek czyszczący. Służy do kalibracji termometrów, stosowanych przy separacji cukrów. W przemyśle farbiarskim jest stosowany jako rozpuszczalnik i rozcieńczalnik do używanych materiałów..
Sztuczne aromaty
Wykorzystywany jest do produkcji aromatów owocowych; na przykład: banan, gruszka, brzoskwinia i ananas, a także aromat winogron itp..
Analityka
Jest używany do oznaczania bizmutu, boru, złota, molibdenu i platyny, a także jako rozpuszczalnik talu. Octan etylu ma zdolność ekstrakcji wielu związków i pierwiastków obecnych w roztworze wodnym, takich jak: fosfor, kobalt, wolfram i arsen.
Syntezy organiczne
Octan etylu jest stosowany w przemyśle jako środek zmniejszający lepkość żywic stosowanych w preparatach fotorezystu. Używany do produkcji acetamidu, octanu acetylu i metyloheptanonu.
Chromatografia
Octan etylu jest używany w laboratoriach jako faza ruchoma w chromatografii kolumnowej i jako rozpuszczalnik ekstrakcyjny. Ponieważ octan etylu ma stosunkowo niską temperaturę wrzenia, łatwo odparowuje, umożliwiając zatężenie substancji rozpuszczonych w rozpuszczalniku.
Entomologia
Octan etylu jest stosowany w entomologii do duszenia owadów umieszczonych w pojemniku, umożliwiając ich zebranie i badanie. Opary octanu etylu zabijają owada, nie niszcząc go i zapobiegając jego twardnieniu, ułatwiając jego montaż do zbioru..
Ryzyka
-LDpięćdziesiąt octanu etylu u szczurów wskazuje na niską toksyczność. Może jednak podrażniać skórę, oczy, skórę, nos i gardło..
-Narażenie na wysokie poziomy może powodować zawroty głowy i omdlenia. Podobnie długotrwałe narażenie może wpływać na wątrobę i nerki..
-Wdychanie octanu etylu w stężeniu 20 000 - 43 000 ppm może spowodować obrzęk płuc i krwotok..
-Dopuszczalne narażenie zawodowe zostało ustalone przez OSHA na 400 ppm w powietrzu, średnio w ciągu 8-godzinnej zmiany roboczej..
Bibliografia
- Steven A. Hardinger. (2017). Ilustrowany słownik chemii organicznej: octan etylu (EtOAc). Odzyskany z: chem.ucla.edu
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. Aminy. (10th wydanie.). Wiley plus.
- Morrison, R. T. and Boyd, R. N. (1990). Chemia organiczna. (5ta wydanie). Od redakcji Addison-Wesley Iberoamericana.
- Wikipedia. (2019). Octan etylu. Odzyskane z: en.wikipedia.org
- Cotton S. (s.f.). Octan etylu. Odzyskany z: chm.bris.ac.uk
- PubChem. (2019). Octan etylu. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Newseed Chemical. (2018). Zastosowania i zastosowania octanu etylu. Odzyskany z: foodsweeteners.com
- Departament Zdrowia Seniorów stanu New Jersey. (2002). Octan etylu. [PDF]. Odzyskany z: nj.gov


Jeszcze bez komentarzy