
Struktura, właściwości, zastosowanie, produkcja octanu potasu
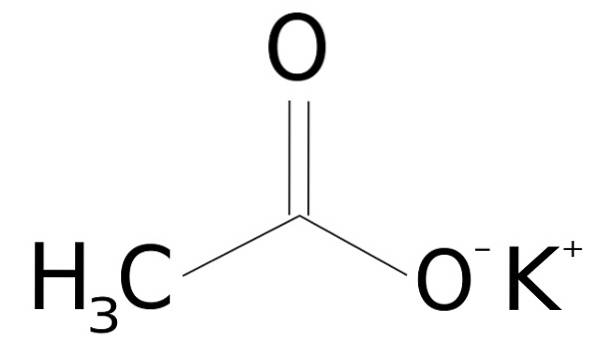
Plik octan potasu jest związkiem organicznym utworzonym przez jon potasu K+ i jon octanowy CH3GRUCHAĆ-. Jego wzór chemiczny to CH3COOK lub KCH3COO, czy też CdwaH.3KOdwa. Jest to bezbarwna lub biała krystaliczna substancja stała, bardzo dobrze rozpuszczalna w wodzie..
Służy do regulowania kwasowości niektórych produktów spożywczych przetworzonych przemysłowo. Ze względu na duże powinowactwo do wody jest używany w laboratoriach lub w niektórych procesach do pochłaniania wody z innych związków, np. Do odwadniania alkoholu..

Octan potasu bierze udział w niektórych reakcjach chemicznych jako ich przyspieszacz oraz w syntezie związków organicznych. Pozwala również na zwiększenie powstawania przeciwciał (naturalnych substancji zwalczających infekcje) w przemysłowych metodach ich wytwarzania..
Jego właściwości w bardzo niskich temperaturach sprawiają, że jest dobrym kandydatem do stosowania w mieszankach do topienia lodu na drogach betonowych w bardzo zimnym klimacie. Według konsultowanych źródeł jest również stosowany w sprzęcie przeciwpożarowym oraz w zespołach do obserwacji komórek w mikroskopach..
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Gęstość
- 3.5 Rozpuszczalność
- 3,6 pH
- 3.7 Inne właściwości
- 3.8 Zachowanie podczas nagrzewania
- 4 Otrzymywanie
- 5 zastosowań
- 5.1 W różnych zastosowaniach
- 5.2 W przemyśle polimerowym
- 5.3 W naukowych i medycznych laboratoriach badawczych
- 5.4 W przemysłowej produkcji przeciwciał
- 5.5 W mieszaninach przeciw zamarzaniu
- 5.6 Jak to działa jako środek przeciw zamarzaniu
- 6 Odnośniki
Struktura
Octan potasu składa się z kationu potasowego K.+ i anion octanowy CH3GRUCHAĆ-. Ta ostatnia jest sprzężoną zasadą kwasu octowego CH3COOH. Jon octanowy CH3GRUCHAĆ- składa się z metylo-CH3 przyłączony do karboksylanu -COO-.
Połączenie między obydwoma jonami jest elektrostatyczne lub jonowe, to znaczy związek między jonem dodatnim i ujemnym.
Nomenklatura
- Octan potasu
- Etanian potasu
- Sól potasowa kwasu octowego
- AcOK
- KOAc
Nieruchomości
Stan fizyczny
Bezbarwne lub białe krystaliczne ciało stałe.
Waga molekularna
98,14 g / mol
Temperatura topnienia
292 ºC
Gęstość
1,6 g / cm3
Rozpuszczalność
Bardzo dobrze rozpuszczalny w wodzie: 256 g / 100 ml w 20 ° C.
pH
5% wodny roztwór octanu potasu ma pH 7,5-9,0.
Inne właściwości
Czasami ma słaby zapach octu. W 10% roztworze nie atakuje aluminium w temperaturze pokojowej, ale w temperaturze 60-70 ° C metal ciemnieje i ulega wżerowaniu.
Przy stężeniach 20% lub wyższych atak powierzchniowy na aluminium występuje w dowolnej temperaturze.
Octan potasu (AcOK) jest dobrze rozpuszczalny w wodzie. Posiada hydrat: KCH3COO.1,5HdwaLub, który jest ciałem stałym otrzymywanym przez krystalizację z wodnych roztworów AcOK.
Zachowanie po podgrzaniu
Jeśli uwodniony octan potasu (AcOK) (KCH3COO.1,5HdwaO) gdy osiągnie 40 ° C zaczyna tracić wodę hydratacyjną.
KCH3COO.1,5HdwaO → KCH3COO + 1,5HdwaLub ↑
Jeśli podgrzewa się bezwodny octan potasu (bez wody: KCH3COO), po osiągnięciu 340 ° C zaczyna się rozkładać tworząc węglan potasu KdwaWSPÓŁ3 zgodnie z następującą reakcją:
2 KCH3COO + 4 Odwa → K.dwaWSPÓŁ3 + 3 HdwaO + 3 COdwa↑
Otrzymywanie
Można go otrzymać przez działanie wodorotlenku potasu KOH na różne związki, takie jak kwas octowy CH3COOH, bezwodnik octowy (CH3WSPÓŁ)dwaO i octan amonu CH3COONH4.
KOH + CH3COOH → CH3GOTOWANIE + H.dwaLUB
Można go również otrzymać w reakcji węglanu potasu K.dwaWSPÓŁ3 lub wodorowęglan potasu KHCO3 z kwasem octowym CH3COOH.
KHCO3 + CH3COOH → CH3GOTOWANIE + H.dwaO + COdwa↑
Octan potasu można krystalizować z roztworu wodnego w celu uzyskania wysokiej czystości.
Aplikacje
W różnych zastosowaniach
Octan potasu jest stosowany w przemyśle spożywczym jako regulator kwasowości. Jest używany jako środek osuszający w metodach chemicznych do pomiaru przepuszczalności pary wodnej niektórych tkanin..
Służy jako środek odwadniający etanol w produkcji tego alkoholu, wychodząc z lignocelulozy, surowca pozyskiwanego z drewna..
Służy do produkcji antybiotyków i jest szeroko stosowany w sprzęcie przeciwpożarowym.
W przemyśle polimerowym
Służy do recyklingu poliuretanów, ponieważ służy do katalizowania lub przyspieszania reakcji hydrolizy i glikolizy wymienionych polimerów, tak że stają się one alkoholami i aminami.
Znajduje również zastosowanie w produkcji organicznych żywic silikonowych.
W naukowych i medycznych laboratoriach badawczych
Octan potasu o wysokiej czystości jest używany w laboratoriach jako odczynnik w chemii analitycznej. Również do prowadzenia badań medyczno-naukowych.
W laboratoriach histopatologicznych służy do zapewnienia neutralnego pH w układach mikroskopowych..

Służy do syntezy heterocyklicznych związków organicznych, które są związkami o różnych cyklach wielkości..
Niektóre mikroelektrody używane do badania właściwości elektrycznych komórek są wypełnione stężonym roztworem octanu potasu..
W przemysłowej produkcji przeciwciał
Octan potasu jest używany do produkcji na dużą skalę przeciwciał monoklonalnych (czyli tych, które pochodzą z tej samej komórki macierzystej) w hodowlach komórkowych. Pozwala stymulować syntezę lub tworzenie przeciwciał.
Przeciwciała to substancje wytwarzane przez niektóre komórki krwi w celu zwalczania zakażeń wirusami lub bakteriami..

W mieszankach przeciw zamarzaniu
Octan potasu został użyty w mieszaninach przeciw zamarzaniu. przeciwoblodzeniowe) w celu wykorzystania ich do topienia lodu na drogach i chodnikach cementowych, a tym samym umożliwienia ich bezpiecznego użytkowania.

Wybór octanu potasu (AcOK) do tego zastosowania wynika z faktu, że 50% wagowo wodny roztwór AcOK jest eutektyczny i ma temperaturę topnienia -62 ° C. Oznacza to, że nawet w temperaturach tak niskich jak -62 ° C roztwór pozostaje stopiony..
Eutektyk to jednorodna mieszanina składników o najniższej temperaturze topnienia ze wszystkich możliwych mieszanin, w tym składników czystych..
Jak to działa jako środek przeciw zamarzaniu
Octan potasu (AcOK) ma bardzo dobrą zdolność do topienia lodu.
W temperaturze -5 ° C jest w stanie stopić 11,5 kg lodu na każdy kg AcOK. Ta właściwość maleje wraz ze spadkiem temperatury, ale nawet przy -50 ° C ma zdolność topienia 1,3 kg lodu na każdy kilogram AcOH..
W temperaturze -5 ° C wydajność ta jest porównywalna z wydajnością chlorku sodu lub soli kuchennej (NaCl), natomiast od -30 ° C znacznie ją przekracza.

Jednak w badaniach przeprowadzonych z AcOK razem z innymi związkami zaobserwowano pewien stopień korozji powierzchni cementu, dlatego rozważano dodanie środków antykorozyjnych do mieszanek niezamarzających..
Z drugiej strony mieszanina octanu potasu (CH3COOK) z mrówczanem potasu (HCOOK) jest doskonałym środkiem przeciw zamarzaniu i nie wymaga antykorozyjnego.
Bibliografia
- Baker, F.J. et al. (1976). Procedury barwienia. Wodne środki utrwalające. We wprowadzeniu do medycznej technologii laboratoryjnej (piąta edycja). Odzyskany z sciencedirect.com.
- Hassan, AA et al. (2018). Indazole: synteza i heterocyklizacja tworząca wiązania. W postępach w chemii heterocyklicznej. Odzyskany z sciencedirect.com.
- NAS. National Library of Medicine. (2019). Octan potasu. Odzyskany z pubchem.ncbi.nlm.nih.gov.
- Das, A. and Alagirusamy, R. (2010). Przenoszenie wilgoci. Metoda odwróconego kubka ze środkiem osuszającym. W nauce o komforcie odzieży. Odzyskany z sciencedirect.com.
- Vargel, C. (2004). Kwasy karboksylowe i ich pochodne. Octany. W korozji aluminium. Odzyskany z sciencedirect.com.
- Cuevas, J. (2014). Techniki rejestracji elektrofizjologicznej. Techniki rejestracji wewnątrzkomórkowej. W module referencyjnym nauk biomedycznych. Odzyskany z sciencedirect.com.
- Fink, J.K. (2018). Poli (uretan) s. Recykling. Solwoliza. In Reactive Polymers: Fundamentals and Applications (wydanie trzecie). Odzyskany z sciencedirect.com.
- Fong, W. i in. (1997). Optymalizacja produkcji przeciwciał monoklonalnych: połączone efekty octanu potasu i perfuzji w bioreaktorze zbiornikowym z mieszaniem. Cytotechnology 24: 47–54. Odzyskany z link.springer.com.
- Daniłow, V.P. et al. (2012). Niskotemperaturowe odczynniki zapobiegające oblodzeniu w wodnych układach solnych zawierających octany i mrówczany. Teoretyczne podstawy inżynierii chemicznej, 2012, tom 46, nr 5, str. 528-535. Odzyskany z link.springer.com.
- Fakeev, A.A. i in. (2012). Badania i rozwój metody otrzymywania octanu potasu o wysokiej czystości. Journal of Applied Chemistry, 2012, tom 85, nr 12, str. 1807-1813. Odzyskany z link.springer.com.



Jeszcze bez komentarzy