
Struktura, właściwości, synteza, zastosowania octanu sodu

Plik Octan sodowy jest solą sodową kwasu octowego o wzorze cząsteczkowym CdwaH.3LUBdwaNa. Składa się z rozpływającego się białego proszku, występującego zasadniczo w dwóch postaciach: bezwodnej i trójwodnej. Obie są bardzo dobrze rozpuszczalne w wodzie, uniwersalnym rozpuszczalniku; ale nie tak dobrze rozpuszczalny w alkoholach lub acetonie.
Bezwodna postać ma gęstość, temperaturę topnienia i temperaturę wrzenia z wyższymi wartościami niż te, które zapewnia trójwodzian octanu sodu. Dzieje się tak, ponieważ cząsteczki wody zakłócają interakcje jonów Na.+ i CH3GRUCHAĆ-.

Octan sodu jest stabilny, zwłaszcza przy przechowywaniu w temperaturze od 2 do 8 ° C; ale jest podatny na działanie silnych utleniaczy i halogenów.
Można go otrzymać w reakcji wodorowęglanu sodu z kwasem octowym. Również w reakcji kwasu octowego z wodorotlenkiem sodu. Obie reakcje są proste do wykonania i niedrogie; pierwszy można zrobić nawet w domu.
Ta sól jest związkiem o niskiej toksyczności. Wywołuje podrażnienia skóry tylko przy częstym i ciągłym kontakcie. Działa lekko drażniąco na oczy, ale może podrażniać drogi oddechowe. Brak informacji o szkodliwym wpływie jego spożycia..
Ma wiele zastosowań i zastosowań, podkreślając swoją funkcję buforowania pH wraz z kwasem octowym. Bufor octanowy ma pKa = 4,7; co zapewnia wysoką skuteczność w regulacji pH w kwaśnym środowisku o wartościach pH od 3 do 6.
Ze względu na niską toksyczność i swoje właściwości jest szeroko stosowany do wzmacniania smaku potraw, a także jako środek zapewniający ochronę przed psuciem się dzięki działaniu przeciwko drobnoustrojom..
Indeks artykułów
- 1 Struktura octanu sodu
- 1.1 Uwodnione kryształy
- 2 Właściwości
- 2.1 Nazwy
- 2.2 Masa molowa
- 2.3 Wygląd
- 2.4 Zapach
- 2.5 Gęstość
- 2.6 Temperatura topnienia
- 2.7 Temperatura wrzenia
- 2.8 Rozpuszczalność
- 2.9 Kwasowość
- 2.10 Podstawowość
- 2.11 Współczynnik załamania światła (ηD)
- 2.12 Pojemność kaloryczna
- 2.13 Temperatura zapłonu
- 2.14 Temperatura samozapłonu
- 2,15 pH
- 2.16 Stabilność
- 2.17 Reakcje
- 3 Synteza
- 4 Zastosowania
- 4.1 Worki termiczne
- 4.2 Przemysłowe
- 4.3 Zastosowanie medyczne
- Roztwór buforowy pH 4,4
- 4.5 Laboratoria badawcze
- 4.6 Konserwacja żywności
- 4.7 Konserwacja betonu
- 5 Eksperymenty dla młodych ludzi
- 5.1 Eksperyment 1
- 5.2 Eksperyment 2
- 6 Toksyczność
- 7 Referencje
Struktura octanu sodu
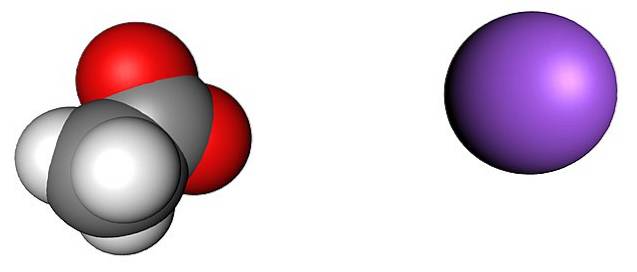
Powyższy obrazek przedstawia jony, które tworzą bezwodne kryształy octanu sodu (bez wody). Fioletowa kula odpowiada kationowi Na+, a jon cząsteczkowy po jego lewej stronie to octan, CH3GRUCHAĆ-, z atomami tlenu reprezentowanymi przez czerwone kule.
Te pary, zgodnie ze wzorem CH3COONa, są w stosunku 1: 1; dla każdego anionu CH3GRUCHAĆ-, musi być kation Na+ przyciąga ujemny ładunek i odwrotnie. W ten sposób przyciąganie między nimi i odpychanie między równymi ładunkami kończy się ustanowieniem wzorców strukturalnych, które definiują kryształ, którego minimalnym wyrazem jest komórka elementarna.
Wspomniana komórka elementarna, podobnie jak cały kryształ, zmienia się w zależności od rozmieszczenia jonów w przestrzeni; nie zawsze jest taki sam, nawet dla tego samego systemu krystalicznego. Na przykład bezwodny octan sodu może tworzyć dwa rombowe polimorfy, z których jeden jest przedstawiony poniżej:
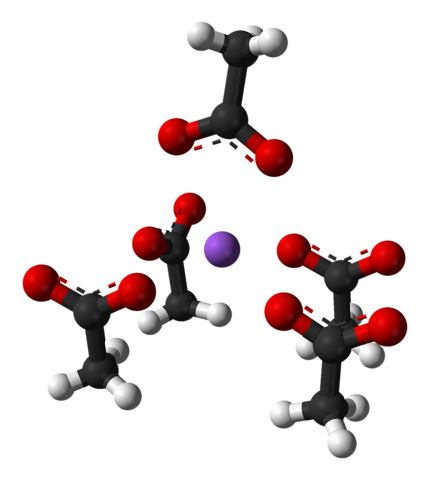
Zwróć uwagę na rozmieszczenie jonów: cztery jony CH3GRUCHAĆ- zamykają Na+ w taki sposób, że „rysują” zniekształconą piramidę o podstawie kwadratu. Każdy z tych ch3GRUCHAĆ- z kolei oddziałują z innym Na+ sąsiadujący.
Uwodnione kryształy
Octan sodu ma duże powinowactwo do wody; w rzeczywistości rozpływa się, to znaczy zatrzymuje wilgoć, dopóki się w niej nie rozpuści. Im wyższa wilgotność, tym szybciej „topi się”. Dzieje się tak, ponieważ zarówno CH3GRUCHAĆ- jak Na+ mogą nawadniać się, otaczać się cząsteczkami wody, które orientują swoje dipole w kierunku swoich ładunków (Na+ Odwa, CH3GRUCHAĆ- HOH).
Kiedy ta sól jest przygotowywana w laboratorium lub w domu, jej powinowactwo do wody jest takie, że nawet w normalnych temperaturach jest już otrzymywana w postaci hydratu; CH3COONa 3HdwaO. Jego kryształy przestają być rombowe i stają się jednoskośne, ponieważ zawierają teraz trzy cząsteczki wody na każdą parę CH3GRUCHAĆ- i Na+.
Nieruchomości
Nazwy
-Octan sodowy.
-Etanian Sodu (IUPAC).
Masa cząsteczkowa
-Bezwodny: 82,03 g / mol.
-Trójwodzian: 136,03 g / mol.
Wygląd
Rozpływający się biały proszek.
Zapach
Do octu po podgrzaniu do rozkładu.
Gęstość
-Bezwodny: 1,528 g / cm3 przy 20 ºC.
-Trójwodzian: 1,45 g / cm3 przy 20 ºC.
Temperatura topnienia
-Bezwodny: 324 ° C (615 ° F, 597 K).
-Trójwodzian: 58 ° C (136 ° F, 331 K).
Temperatura wrzenia
-Bezwodny: 881,4 ° C (1618,5 ° F, 1154,5 K).
-Trihydrat: 122 ° C (252 ° F, 395 K). Rozkłada się.
Rozpuszczalność
W wodzie
-Bezwodny: 123,3 g / 100 ml w 20 ° C.
-Trihydrat: 46,4 g / 100 ml w 20 ° C.
W metanolu
16 g / 100 gw temperaturze 15 ºC.
W etanolu
5,3 g / 100 ml (trójwodzian).
W acetonie
0,5 g / kg w 15 ° C.
Kwasowość
pKa: 24 (20 ºC).
Zasadowość
pKb: 9,25. Tutaj udowodniono, że octan sodu jest solą zasadową, ponieważ ma pKb mniej niż jego pKa.
Współczynnik załamania (ηD)
1,464
Pojemność kaloryczna
-100,83 J / mol K (bezwodny).
-229,9 J / mol K (trójwodzian).
punkt zapłonu
Powyżej 250ºC.
Temperatura samozapłonu
600 ºC.
pH
8,9 (roztwór 0,1 M w 25 ° C).
Stabilność
Stabilny. Niekompatybilny z silnymi utleniaczami i halogenami. Wrażliwy na wilgoć.
Reakcje
Octan sodu może tworzyć ester w reakcji z halogenkiem alkilu; na przykład bromoetan:
CH3COONa + BrCHdwaCH3 => CH3COOCHdwaCH3 + NaBr
Dekarboksylany octanu sodu do metanu (piroliza) w obecności NaOH:
CH3COONa + NaOH => CH4 + NadwaWSPÓŁ3
Reakcja jest katalizowana przez sole cezu.
Synteza
Octan sodu można tanio wyprodukować w laboratorium poprzez reakcję wodorowęglanu sodu z kwasem octowym:
NaHCO3 + CH3COOH => CH3COONa + H.dwaWSPÓŁ3
Reakcji tej towarzyszy obecność w roztworze intensywnego bulgotania, spowodowanego rozkładem kwasu węglowego w wodzie i dwutlenku węgla..
H.dwaWSPÓŁ3 => H.dwaO + COdwa
W przemyśle octan sodu jest wytwarzany w reakcji kwasu octowego z wodorotlenkiem sodu.
CH3COOH + NaOH => CH3COONa + H.dwaLUB
Aplikacje
Torby termiczne
Octan sodu jest używany do produkcji worków termicznych.
Początkowo kryształy soli rozpuszcza się w dużej ilości wody, aby przygotować roztwór, który staje się przesycony..
Następnie roztwór jest podgrzewany do temperatury wyższej niż 58 ºC, która jest jego temperaturą topnienia. Przesycony roztwór pozostawia się do ostygnięcia do temperatury pokojowej i nie obserwuje się tworzenia kryształów; roztwór jest przechłodzony.
Brak kryształów tłumaczy się tym, że cząsteczki cieczy są zbyt nieuporządkowane i nie mają odpowiedniej orientacji, aby osiągnąć temperaturę krystalizacji. Ciecz jest w stanie metastabilnym, stanie braku równowagi.
Biorąc pod uwagę niestabilność przechłodzonej cieczy, wszelkie zakłócenia są wystarczające do zainicjowania krystalizacji. W przypadku worków termicznych, naciska się mocowanie mechaniczne, aby wymieszać ciecz i zainicjować tworzenie się kryształów i krzepnięcie roztworu trihydratu octanu sodu..
Gdy zachodzi krystalizacja, temperatura wzrasta. Kryształy trójwodzianu octanu sodu przybierają wygląd lodu, ale są gorące, dlatego nazywa się to „gorącym lodem”..
Przemysłowy
-Octan sodu jest stosowany w przemyśle tekstylnym jako zaprawa w procesie barwienia tkanin
-Neutralizuje odpady kwasu siarkowego
-Wykorzystywany jest w przetwórstwie bawełny do produkcji wacików, do użytku osobistego i medycznego
-Stosowany jest do wytrawiania metali przed ich chromowaniem
-Współpracuje, aby w procesie produkcji kauczuku syntetycznego nie dochodziło do wulkanizacji chloroprenu
-Przyczynia się do oczyszczania glukozy
-Stosowany jest do garbowania skór.
Zastosowanie medyczne
Octan sodu jest jednym ze związków stosowanych do dostarczania elektrolitów podawanych pacjentom dożylnie..
Służy do korygowania poziomu sodu u pacjentów z hiponatremią, a także w korekcji kwasicy metabolicznej i alkalizacji moczu..
Roztwór buforowy PH
Jest stosowany jako regulator pH w wielu reakcjach enzymatycznych, które zachodzą między pH 3 a pH 6.
Różne pH roztworu buforu octanowego uzyskuje się przez zmianę stężenia kwasu octowego i octanu sodu..
Tak więc, na przykład, aby uzyskać pH 4,5, roztwór buforowy ma stężenie kwasu octowego 3,8 g / l, a stężenie bezwodnego octanu sodu 3,0 g / l..
Stężenie buforu octanowego można zwiększyć, zwiększając w tej samej proporcji składniki roztworu niezbędne do uzyskania żądanego pH.
Bufor octan / acetonitryl jest używany w elektroforezie kapilarnej do rozdzielania fotoberberyn.
Laboratoria badawcze
-Octan sodu jest słabym środkiem nukleofilowym stosowanym w anionowej polimeryzacji β-laktonu.
-Jest stosowany jako odczynnik w jądrowym rezonansie magnetycznym makrocząsteczek biologicznych.
-Służy do ekstrakcji DNA z komórek. Sód to kation, który oddziałuje z ujemnymi ładunkami fosforanów obecnymi w DNA, co pomaga w ich kondensacji. W obecności etanolu DNA tworzy osad, który może następnie rozdzielić się na warstwę wodną.
Konserwacja żywności
-Pomaga zapobiegać rozwojowi bakterii, a także zapobiega tworzeniu się nadmiernej kwasowości, która powoduje psucie się żywności, utrzymując w ten sposób określone pH.
-Sód obecny w octanie poprawia smak potraw.
-Octan sodu stosuje się do przygotowania kiszonych warzyw: ogórka, marchwi, cebuli itp. Ponadto znajduje zastosowanie w konserwowaniu mięsa.
Konserwacja betonu
Beton ulega zniszczeniu pod działaniem wody, co skraca jego czas trwania. Octan sodu działa jak uszczelniacz do betonu, który sprawia, że jest on wodoodporny, przedłużając jego początkowe właściwości.
Eksperymenty z młodzieżą
Eksperyment 1
Prostym eksperymentem jest synteza octanu sodu poprzez reakcję wodorowęglanu sodu z octem (5% kwas octowy).
30 ml octu umieszcza się w zlewce i dodaje około 3,5 g wodorowęglanu..
W reakcji tworzy się octan sodu i kwas węglowy. Kwas rozkłada się na dwutlenek węgla i wodę. Wytwarzanie dwutlenku węgla spowoduje intensywne bulgotanie w roztworze.
Aby zebrać octan sodu, woda odparowuje, ogrzewając roztwór.
Eksperyment 2
Innym prostym doświadczeniem jest tworzenie kryształów trihydratu octanu sodu.
W tym celu odważa się około 20 g trihydratu octanu sodu i umieszcza w zlewce, a następnie dodaje 10 ml wody. Roztwór ogrzewa się do temperatury powyżej 58 ° C.
Octan sodu jest całkowicie rozpuszczony, aby zapewnić przesycenie roztworu. Wcześniej naczynie Pietri umieszczano na zimnej powierzchni.
Zawartość zlewki z trihydratem octanu wlewa się powoli do naczynia Pietri. Temperatura cieczy w kapsułce zaczyna spadać, nawet poniżej temperatury topnienia, bez obserwacji krystalizacji lub zestalania trójwodzianu octanu sodu..
Zwykle w celu wywołania krystalizacji trihydratu octanu sodu dodaje się niewielką ilość soli, która służy jako rdzeń krystalizacyjny. Innym razem występuje niewielkie zaburzenie roztworu, aby zainicjować krystalizację octanu sodu.
Kryształy trójwodzianu octanu sodu wyglądają jak lód, ale jeśli je dotkniesz, zauważysz, że są stosunkowo gorące. Z tego powodu sól nazywana jest „gorącym lodem”.
Toksyczność
Octan sodu jest związkiem o bardzo niskiej toksyczności. Nie jest również klasyfikowany jako działający uczulająco na skórę i drogi oddechowe..
Ponadto octan sodu nie jest klasyfikowany jako czynnik mutagenny na komórki rozrodcze, rakotwórczy lub toksyczny dla rozrodczości..
Krótko mówiąc, jest lekko drażniący dla oczu. Przy wdychaniu mogą wystąpić podrażnienia dróg oddechowych. Częsty i ciągły kontakt ze skórą może powodować podrażnienia.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- WorldOfChemicals. (16 stycznia 2017). Jak przygotować octan sodu w domu? Odzyskany z: medium.com
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Octan sodowy. Baza danych PubChem. CID = 517045. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- S. Cameron, K. M. Mannan i M. O. Rahman. (1976). Struktura krystaliczna trihydratu octanu sodu. Acta Cryst. B32, 87.
- Wikipedia. (2019). Octan sodowy. Odzyskane z: en.wikipedia.org
- Helmenstine, dr Anne Marie (24 stycznia 2019). Przygotuj gorący lód z octu i sody oczyszczonej. Odzyskany z: thinkco.com
- Książka chemiczna. (2017). Octan sodowy. Odzyskane z: chemicalbook.com
- Wasserman Robin. (2019). Zastosowania octanu sodu. Odzyskany z: livestrong.com
- Drugbank. (2019). Octan sodowy. Odzyskany z: drugbank.ca



Jeszcze bez komentarzy