
Acinetobacter baumannii Charakterystyka, morfologia, objawy
Acinetobacter baumannii Jest to bakteria Gram-ujemna należąca do rzędu Pseudomonas. W całej swojej historii taksonomicznej znajdował się w rodzajach Micrococcus, Moraxella, Alcaligenes, Mirococcuscalco-aceticus, Herellea Y Achromobacter, dopóki nie został umieszczony w obecnym gatunku w 1968 roku.
DO. baumannii jest to bakteria chorobotwórcza, uważana za gatunek najczęściej wywołujący zakażenia w obrębie jej rodzaju. Stwierdzono, że bierze udział w różnego rodzaju infekcjach, takich jak posocznica, zapalenie płuc i zapalenie opon mózgowych.
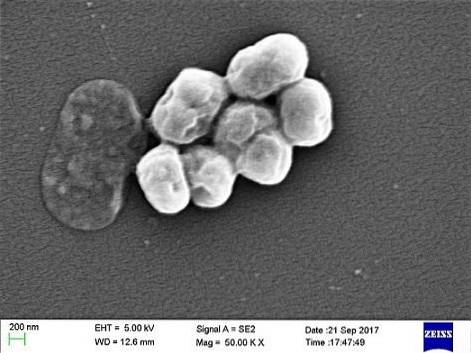
Jest to pasożyt oportunistyczny, który często występuje w chorobach szpitalnych lub szpitalnych. Transmisja przez wentylację mechaniczną została zidentyfikowana jako ważna przyczyna zakażenia, szczególnie na oddziałach intensywnej terapii.
Pomimo tego, że jest uważany za patogen o niskim stopniu złośliwości, ma zdolność zwiększania zjadliwości w szczepach zaangażowanych w częste infekcje. Ma dużą zdolność do rozwijania oporności i wielooporności na antybiotyki.
W szpitalach przenosi się głównie przez kontakt personelu, przy użyciu skażonych materiałów szpitalnych, a także drogą powietrzną na krótkich dystansach.
Światowa Organizacja Zdrowia obejmuje A. baumannii na liście opornych patogenów, dla których pilnie potrzebne są nowe antybiotyki, nadając jej kategorię 1, z priorytetem krytycznym.
Indeks artykułów
- 1 Charakterystyka Acinetobacter baumannii
- 2 Morfologia
- 3 Metabolizm
- 4 Oporność na antybiotyki
- 5 Patologie
- 6 Objawy
- 7 Leczenie
- 8 Odniesienia
Charakterystyka Acinetobacter baumannii
Wszystkie gatunki z rodzaju Acinetobacter mają szeroką dystrybucję w różnych niszach naturalnych. A. baumannii może w naturalny sposób zasiedlać skórę ludzi zdrowych, kolonizując powierzchnie śluzówki, co stanowi ważny rezerwuar epidemiologiczny. Jednak siedlisko A. baumannii występuje prawie wyłącznie w warunkach szpitalnych.
Bakterie te nie mają wici ani struktur używanych do poruszania się. Jednak osiągają ruch przez struktury, które pozwalają im się rozciągać i cofać, oraz poprzez mechanizmy chemiczne, takie jak wydzielanie warstwy egzopolisacharydu o wysokiej masie cząsteczkowej znajdującej się za bakteriami..
A. baumannii może kolonizować dużą liczbę żywych lub obojętnych środowisk i ma dużą zdolność przetrwania na sztucznych powierzchniach przez dłuższy czas.
Zdolność ta prawdopodobnie wynika z ich zdolności do przeciwdziałania odwodnieniu, wykorzystywania różnych źródeł węgla na różnych szlakach metabolicznych oraz zdolności do tworzenia biofilmów. Z tego powodu często znajduje się go w materiałach szpitalnych, takich jak cewniki i urządzenia do wentylacji mechanicznej..
Morfologia
A. baumannii to coccobacillus o pośrednim kształcie pomiędzy ziarniakami i pręcikami. Mierzą 1,5 do 2,5 na 1 do 1,5 mikrona, gdy populacje są w logarytmicznej fazie wzrostu. Są bardziej kuliste, gdy osiągną fazę stacjonarną.
Metabolizm
Bakterie A. baumannii nie jest to urządzenie do fermentacji glukozy; jest ściśle tlenowy, to znaczy do metabolizmu potrzebuje tlenu.
Gatunek z rodzaju Acinetobacter jako jedyni z rodziny Moraxellaceae nie posiadają oksydaz cytochromu c, dla których dają negatywne wyniki w testach oksydaz.
A. baumannii rośnie w temperaturach wahających się od 20 do 44ºC, przy optymalnej temperaturze od 30 do 35ºC.
Odporność na antybiotyki
Stałe wytwarzanie oporności na antybiotyki nie tylko utrudnia leczenie i kontrolę zakażeń wywołanych przez A. baumannii, sprzyja również selekcji endemicznych i epidemicznych szczepów odpornych na wiele chorób.
Niektóre wewnętrzne mechanizmy A. baumannii, które sprzyjają oporności na antybiotyki:
- Obecność β-laktamazy nadają oporność na β-laktamy.
- Produkcja określonych enzymów, takich jak amoniglukozyd-3'-fosfotransferaza VI, inaktywuje amikacynę.
- Obecność oksacylinazy OXA-51 hydrolizuje penicyliny i karbapenemy.
- Obecność i nadekspresja pomp refluksowych, które są pompami, które wydalają z komórki małe cząsteczki, którym udaje się przeniknąć do cytoplazmy, zmniejszając w ten sposób ich wrażliwość na antybiotyki.
Biofilmy generowane przez A. baumannii zmieniają metabolizm mikroorganizmów, zmniejszając ich wrażliwość na antybiotyki, a także zapewniają fizyczną barierę przed dużymi cząsteczkami i zapobiegają odwodnieniu bakterii.
Patologie
A. baumannii kolonizuje nowego żywiciela poprzez kontakt z zarażonymi ludźmi lub skażonym sprzętem medycznym. Przede wszystkim ta bakteria przyczepia się do skóry i powierzchni śluzówki. Aby się rozmnażać, musi przetrwać antybiotyki i inhibitory oraz warunki panujące na tych powierzchniach..
Wzrost liczby bakterii na powierzchni błony śluzowej, szczególnie w warunkach hospitalizacji w kontakcie z cewnikami wewnątrznaczyniowymi lub rurkami dotchawiczymi, może zwiększać ryzyko zakażenia dróg oddechowych i krwiobiegu..
Szpitalne zapalenie płuc jest najczęstszą z infekcji wywoływanych przez A. baumanii. Zwykle zakontraktowane na oddziałach intensywnej opieki medycznej przez pacjentów otrzymujących mechanicznie wspomagane oddychanie.
A. baumanii spowodowało również poważne problemy z infekcjami personelu wojskowego po powojennych urazach, szczególnie w Iraku i Afganistanie. W szczególności z powodu zapalenia kości i szpiku i infekcji tkanek miękkich, które mogą powodować martwicę i zapalenie tkanki łącznej.
Istnieje również ryzyko zapalenia opon mózgowych A. baumanii u pacjentów po neurochirurgii.
Osoby podatne na infekcje wg A. baumanii obejmują osoby, które wcześniej były poddawane stosowaniu antybiotyków, poważnym operacjom, oparzeniom, urazom, immunosupresji lub stosowaniu inwazyjnych wyrobów medycznych, głównie wentylacji mechanicznej, na Oddziałach Intensywnej Terapii.
Objawy
Nie ma specyficznej symptomatologii infekcji wg A. baumanii. Każda z różnych infekcji wywoływanych przez tę bakterię ma swoje własne charakterystyczne objawy..
Ogólnie objawy infekcji, które mogą obejmować A. baumanii lub inne bakterie oportunistyczne, takie jak Klebsiella pneumoniae Y Streptococcus pneumoniae, może obejmować gorączkę, dreszcze, wysypkę, bolesne oddawanie moczu, pilną potrzebę częstego oddawania moczu, splątanie lub zmienione stany psychiczne, nudności, ból mięśni, ból w klatce piersiowej i kaszel.
Leczenie
Antybiotyki stosowane w leczeniu zakażeń A. baumannii są bardzo ograniczone ze względu na ich dużą zdolność do pozyskiwania rezystorów i multi-rezystorów. Z tego powodu ważne jest, aby określić wrażliwość każdego szczepu na różne antybiotyki, aby zagwarantować skuteczność każdego leczenia..
Biorąc pod uwagę oporność na karbapenemy, uciekano się do stosowania polimyksyn, w szczególności kolistyny, pomimo stosunkowo niskiego wskaźnika oporności i jej skutków ubocznych na nerki..
Jednak już wykryto szczepy oporne na kolistynę. Jako alternatywę dla oporności na te antybiotyki zastosowano terapię skojarzoną.
Bibliografia
- Bergogne-Bérézin, E. & Towner, K.J. Acinetobacter spp. jako patogeny szpitalne: cechy mikrobiologiczne, kliniczne i epidemiologiczne. Clin Microbiol Rev, 9 (1996), str. 148-165.
- Fournier, P.E., Richet, H. (2006). Epidemiologia i kontrola Acinetobacter baumanii w zakładach opieki zdrowotnej. Clinical Infectious Diseases, 42: 692–9.
- Hernández Torres, A., García Vázquez, E., Yagüe, G. &, Gómez Gómez, J. (2010) Acinetobacter baumanii Multireistant: aktualna sytuacja kliniczna i nowe perspektywy Revista Española de Quimioterapia, 23 (1): 12-19.
- Maragakis LL, Perl TM. Acinetobacter baumanii: epidemiologia, oporność na środki przeciwdrobnoustrojowe i opcje leczenia. Clin Infec Dis 2008; 46: 1254-63.
- McConnell, M.j., Actis, L. & Pachón, J. (2013) Acinetobacter baumannii: infekcje ludzkie, czynniki przyczyniające się do patogenezy i modele zwierzęce. FEMS Microbiology Reviews, 37: 130-155.
- Peleg, A.Y., Seifert, H. & Paterson, D.L. (2008). Acinetobacter baumannii: pojawienie się skutecznego patogenu. Clinical Microbiology Reviews, 21 (3): 538–82.
- Vanegas-Múnera, J.M., Roncancio-Villamil, G. & Jiménez-Quiceno, J.N. (2014). Acinetobacter baumannii: znaczenie kliniczne, mechanizmy oporności i diagnostyka. CES Medicine Magazine, 28 (2): 233–246.



Jeszcze bez komentarzy