
Struktura, właściwości, zastosowanie siarczynu sodu (Na2SO3)

Plik siarczyn sodu lub siarczyn sodu, którego wzór chemiczny to Nadwapołudniowy zachód3, jest rozpuszczalną solą sodową otrzymywaną jako produkt reakcji kwasu siarkowego (lub tlenku siarki (IV)) z wodorotlenkiem sodu.
W latach 1650-1660 Glauber rozpoczął produkcję siarczynu sodu z soli kuchennej (NaCl) i stężonego kwasu siarkowego. Proces ten uważany jest za początek przemysłu chemicznego.

W procesie siarczynowym powstaje miazga drzewna, którą obserwuje się jako prawie czyste włókno celulozowe przy użyciu różnych soli kwasu siarkowego do ekstrakcji ligniny z zrębków drzewnych..
Zatem siarczyny mają wiele różnych typów zastosowań, w tym w przemyśle spożywczym jako dodatek. Do jego najważniejszych funkcji należy zdolność hamowania enzymatycznego i nieenzymatycznego brązowienia, kontrola i hamowanie wzrostu drobnoustrojów, zapobieganie jełczeniu oksydacyjnemu oraz modyfikacja właściwości reologicznych żywności..
Indeks artykułów
- 1 Przygotowanie siarczynu sodu
- 2 Struktura chemiczna
- 3 Właściwości
- 3.1 Właściwości chemiczne
- 3.2 Właściwości fizyczne
- 4 Zastosowania
- 5 Ryzyka
- 5.1 Skutki narażenia na związek
- 5.2 Ekotoksyczność
- 5.3 Spożycie żywności z konserwantami
- 6 Odnośniki
Przygotowanie siarczynu sodu
Generalnie w skali laboratoryjnej siarczyn sodu powstaje w wyniku reakcji roztworu wodorotlenku sodu z gazowym dwutlenkiem siarki (2NaOH + SOdwa → Nadwapołudniowy zachód3 + H.dwaLUB).
Następnie ewolucja systemu operacyjnegodwa Dodając kilka kropli stężonego kwasu solnego wskażesz, czy wodorotlenek sodu jest prawie wyczerpany, przekształcony w wodny siarczyn sodu (Nadwapołudniowy zachód3 + 2HCl → 2NaCl + SOdwa + H.dwaLUB).
Z drugiej strony ten związek chemiczny jest otrzymywany na skalę przemysłową w reakcji ditlenku siarki z roztworem węglanu sodu..
Początkowa kombinacja generuje wodorosiarczyn sodu (NaHSO3), który następnie reaguje z wodorotlenkiem sodu lub węglanem sodu, przekształca się w siarczyn sodu. Reakcje te można podsumować w globalnej reakcji SOdwa + NadwaWSPÓŁ3 → Nadwapołudniowy zachód3 + WSPÓŁdwa.
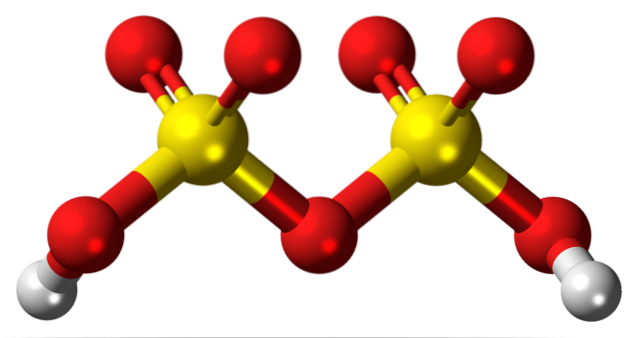
Struktura chemiczna
Wszystkie formy siarczynu sodu charakteryzują się tym, że są białymi, krystalicznymi i higroskopijnymi ciałami stałymi, które mają zdolność łatwego przyciągania i zatrzymywania cząsteczek wody z otaczającego środowiska, które zwykle ma temperaturę pokojową..
Rodzaj struktury krystalicznej związany jest z obecnością wody w związku. Bezwodny siarczyn sodu ma strukturę rombową lub heksagonalną, a jeśli w związku znajdują się cząsteczki wody, zmienia się jego struktura (na przykład heptahydrat siarczynu sodu ma strukturę jednoskośną).
Nieruchomości
Gatunek ten ma pewne właściwości fizyczne i chemiczne, które odróżniają go od innych soli, które opisano poniżej:
Właściwości chemiczne
Jako nasycony wodny roztwór substancja ta ma pH około 9. Dodatkowo, roztwory wystawione na działanie powietrza ostatecznie utleniają się do siarczanu sodu..
Z drugiej strony, jeśli pozwala się na krystalizację siarczynu sodu z roztworu wodnego w temperaturze pokojowej lub niższej, robi to jako heptahydrat. Kryształy heptahydratu wykwitają w gorącym, suchym powietrzu, utleniają się również w powietrzu, tworząc siarczany..
W tym sensie postać bezwodna jest znacznie bardziej odporna na utlenianie przez powietrze. Siarczyn jest niekompatybilny z kwasami, silnymi utleniaczami i wysokimi temperaturami. Jest również nierozpuszczalny w amoniaku i chlorze.
Właściwości fizyczne
Bezwodny siarczyn sodu ma masę molową 126,43 g / mol, gęstość 2,633 g / cm3, ma temperaturę topnienia 33,4 ° C (92,1 ° F lub 306,5 K), temperaturę wrzenia 1429 ° C (2604 ° F lub 1702 K) i nie jest łatwopalny. Podobnie rozpuszczalność (mierzona w temperaturze 20 ° C) wynosi 13,9 g / 100 ml..
Aplikacje
Ze względu na swoje właściwości reaktywne siarczyn sodu jest bardzo wszechstronny i obecnie i szeroko stosowany w różnych gałęziach przemysłu..
-Znajduje szerokie zastosowanie w uzdatnianiu wody i eliminacji tlenu rozpuszczonego w wodzie kotłowej..
-Znajduje również zastosowanie w przemyśle papierniczym (masa celulozowa półpłynna).
-W fotografii jest używany do produkcji wywoływaczy.
-W odpowiednim stopniu jest stosowany w konserwowaniu żywności i przeciwutleniaczach.
-W przemyśle tekstylnym znajduje zastosowanie w procesach bielenia i antychloro.
-Jest również stosowany jako środek redukujący.
-Ponadto jest używany do wtórnego odzyskiwania szybów naftowych.
-Jest nawet używany do produkcji związków organicznych, barwników, tuszy, sztucznego jedwabiu wiskozowego i kauczuków..
-Jest używany do produkcji wielu chemikaliów, w tym siarczanu potasu, siarczynu sodu, krzemianu sodu, podosiarczynu sodu i siarczanu glinu sodu..
Ryzyka
Skutki narażenia na związek
Długotrwała lub powtarzająca się ekspozycja na tę substancję może powodować zapalenie skóry i reakcje nadwrażliwości. Ekspozycja na osoby wrażliwe na siarczyny, z astmą i atopią może spowodować poważne skurcze oskrzeli i zmniejszyć poziom wymuszonej objętości wydechowej..
Podobnie, kwaśny rozkład siarczynu sodu może uwalniać toksyczne i niebezpieczne opary tlenków siarki, w tym dwutlenku siarki, które mogą prowadzić do trwałego pogorszenia stanu płuc w wyniku przewlekłego i ostrego narażenia..
Podobnie ostre zatrucie dwutlenkiem siarki występuje rzadko, ponieważ gaz jest łatwo wykrywalny. To jest tak irytujące, że nie można tolerować kontaktu.
Objawy obejmują kaszel, chrypkę, kichanie, łzawienie oczu i duszność. Jednak pracownicy z nieuniknionymi dużymi narażeniami mogą doznać poważnego i prawdopodobnie śmiertelnego uszkodzenia płuc..
Ekotoksyczność
Siarczyn sodu jest bezpiecznym roztworem, który jest powszechnie stosowany jako środek do odchlorowywania ścieków. Wysokie stężenia przyczyniają się do wysokiego chemicznego zapotrzebowania na tlen w środowiskach wodnych.
Spożycie żywności z konserwantami
Jednym z dodatków, które mogą powodować problemy u osób wrażliwych, jest grupa zwana środkami siarczynowymi, która obejmuje różne nieorganiczne dodatki siarczynowe (E220-228), w tym siarczyn sodu (SOdwa).
U osób nadwrażliwych lub chorych na astmę spożywanie pokarmów zawierających siarczyny lub wdychanie dwutlenku siarki może być toksyczne.
Związki te są odpowiedzialne za zwężenie oskrzeli, które powoduje duszność. Jedynym sposobem leczenia tej nadmiernej reakcji jest unikanie pokarmów i napojów zawierających siarczyny..
Bibliografia
1. Britannica, E. (s.f.). Siarczyn sodu. Pobrane z britannica.com
2. Informacje o żywności. (s.f.). E221: siarczyn sodu. Pobrane z food-info.net
3. PubChem. (s.f.). Siarczyn sodu. Odzyskany z pubchem.ncbi.nlm.nih.gov
4. Solvay zrównoważony. (s.f.). Siarczyn sodu. Pobrane zolvay.us
5. Wikipedia. (s.f.). Siarczyn sodu. Odzyskany z en.wikipedia.org

Jeszcze bez komentarzy