
Podłoże, przygotowanie i stosowanie agaru Baird Parker
Plik Agar Bairda Parkera Jest to stałe, selektywne i zróżnicowane podłoże hodowlane. Został utworzony w 1962 roku do wykrywania i liczenia gronkowców koagulazo-dodatnich (Staphylococcus aureus).
Składa się z hydrolizatu kazeiny trzustkowej, ekstraktu mięsnego, ekstraktu drożdżowego, chlorku litu, glicyny, pirogronianu sodu, tellurynu potasu, agaru i emulsji z żółtka jaja..
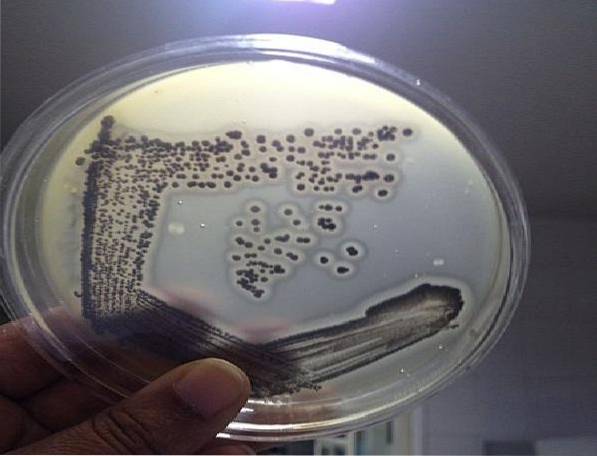
Baird Parker Agar opiera się na zdolności S. aureus redukcja tellurynu i produkcja lecytynazy. Obie właściwości tworzą kolonię o specyficznych cechach charakterystycznych dla tego gatunku. Dlatego jest wysoce skuteczny w wykrywaniu tego mikroorganizmu..
Typowe kolonie S. aureus Są czarne lub ciemnoszare, z bezbarwną obwódką i jasną aureolą, która je otacza, co odróżnia je od innych mikroorganizmów. Ten patogen można znaleźć w próbkach klinicznych, wodzie, kosmetykach oraz surowej lub gotowanej żywności..
Jego rozpoznanie lub wykrycie ma ogromne znaczenie ze względu na różnorodność wywoływanych przez niego patologii, takich jak między innymi zatrucia pokarmowe, zespół oparzonej skóry, zespół wstrząsu toksycznego, ropnie, zapalenie opon mózgowo-rdzeniowych, posocznica, zapalenie wsierdzia..
Indeks artykułów
- 1 Uzasadnienie
- 1.1 Siła odżywcza
- 1.2 Selektywne
- 1.3 Różnicowe
- 2 Przygotowanie
- 2.1 Emulsja z żółtka jaja
- 2.2 Telluryn potasu 1% w / v
- 2.3 Przygotowanie pożywki
- 3 Użyj
- 3.1 Próbki kliniczne
- 3.2 Próbki żywności
- 3.3 Próbki wody
- 4 Kontrola jakości
- 5 Zaleceń
- 6 Odnośniki
Podstawa
Odżywcza moc
Hydrolizat kazeiny trzustkowej, wyciąg z mięsa i ekstrakt z drożdży są źródłami składników odżywczych, witamin i minerałów niezbędnych do ogólnego rozwoju drobnoustrojów, a pirogronian i glicyna to związki sprzyjające specyficznemu wzrostowi Staphylococcus aureus.
Selektywny
Baird Parker Agar jest selektywny, ponieważ zawiera substancje hamujące wzrost flory towarzyszącej, jednocześnie sprzyjając rozwojowi S. aureus. Związkami hamującymi są chlorek litu i telluryn potasu..
Mechanizm różnicowy
To medium umożliwia różnicowanie S. aureus pozostałych gronkowców koagulazo-ujemnych. S. aureus ma zdolność redukowania telluru do wolnego metalicznego czarnego telluru, tworząc czarne lub ciemnoszare kolonie.
Podobnie, żółtko jaja dostarcza substratów do wykazania obecności enzymu lecytynazy i lipazy.. S. aureus jest dodatni względem lecytynazy i dlatego wokół kolonii będzie widoczne wyraźne halo, co wskazuje, że lecytyna została zhydrolizowana.
W tym sensie pojawienie się na tym agarze błyszczących czarnych lub ciemnoszarych kolonii z jasną aureolą wokół nich wskazuje na obecność S. aureus.
Jeśli tworzy się strefa strącania, świadczy to o aktywności lipazy. Niektóre odmiany S. aureus są lipazo-dodatnie i inne ujemne.
W przypadku, gdy S. aureus Jeśli lipaza jest dodatnia, wokół czarnej lub ciemnoszarej kolonii będzie widoczny nieprzezroczysty obszar, a następnie jasna otoczka spowodowana działaniem lecytynazy.
Kolonie bakterii inne niż S. aureus zdolne do wzrostu w tej pożywce będą tworzyć bezbarwne lub brązowe kolonie bez otaczającego halo.
Można również zobaczyć nietypowe czarne kolonie z bezbarwną obwódką lub bez, ale bez jasnego halo. Te kolonie nie powinny być brane pod uwagę, nie odpowiadają S. aureus.
Przygotowanie
Emulsja z żółtka jaja
Weź świeże jajo kurze, dobrze je umyj i umieść w 70% alkoholu na 2 do 3 godzin. Jajko jest następnie aseptycznie otwierane i białko ostrożnie oddzielane od żółtka. Następnie pobiera się 50 ml żółtka i miesza z 50 ml sterylnego roztworu fizjologicznego..
Telluryn potasu 1% w / v
Niektóre domy komercyjne sprzedają gotowy do użycia 1% telluryn potasu. Jest dodawany do pożywki, zanim podłoże zestali się.
Aby przygotować ten roztwór w laboratorium, odważono 1,0 g tellurynu potasu i rozpuszczono w jednej części wody. Następnie ilość wody jest uzupełniana do osiągnięcia 100 ml. Roztwór należy sterylizować metodą filtracji.
Przygotowanie pożywki
Odważyć 60 g odwodnionej pożywki i rozpuścić w 940 ml wody destylowanej. Pozostaw mieszaninę na około 5 do 10 minut.
Zastosuj ciepło, często mieszając medium, aby poprawić proces rozpuszczania. Doprowadź do wrzenia przez minutę. Sterylizuj w autoklawie w 121 ° C przez 15 minut.
Odstawić, aż osiągnie temperaturę 45 ° C i dodać 50 ml emulsji z żółtka jaja i 10 ml 1% tellurynu. Dobrze wymieszaj i wlej 15-20 ml na sterylne szalki Petriego..
Pozostawić do zestalenia, ułożyć w odwróconej półce i przechowywać w lodówce do czasu użycia.
Końcowe pH przygotowanej pożywki musi wynosić 6,8 ± 0,2.
Przed zaszczepieniem próbki poczekaj, aż płytka osiągnie temperaturę pokojową. Siać płytki przez wysiew pasmowy lub powierzchniowy szpatułką Drigalskiego.
Odwodnione podłoże ma jasnobrązową barwę, a przygotowane podłoże jest jasno bursztynowe.
Posługiwać się
Próbki kliniczne
Próbki kliniczne wysiewa się bezpośrednio, wyładowując część materiału na jednym końcu płytki, a stamtąd jest przesiewana przez wyczerpanie. Inkubować przez 24–48 godzin w temperaturze 35–37 ° C.
Próbki żywności
Odważyć 10 g próbki żywności i homogenizować w 90 ml 0,1% wody peptonowej, z której w razie potrzeby przygotowuje się rozcieńczenia. Zaszczepić płytki w trzech powtórzeniach 0,3 ml przygotowanych roztworów i wysiać na powierzchnię szpatułką Drigalskiego. Inkubować przez 24–48 godzin w temperaturze 35–37 ° C.
Ta metodologia pozwala zliczać typowe uzyskane kolonie i jest idealna w przypadku obecności S. aureus powyżej 10 CFU na gr / ml próbki.
Jeśli kwota S. aureus Jest niewielka lub występuje dużo towarzyszącej flory, sugeruje się wzbogacenie próbki w bulion tryptykazowo-sojowy 10% NaCl i 1% pirogronianu sodu. Będzie to sprzyjało rozwojowi domeny S. aureus i będzie hamować rozwój towarzyszącej flory. Mętne probówki wysiewa się na agarze Baird Parker..
Próbki wody
W sterylizowanym systemie filtracji próżniowej odsącza się 100 ml badanej wody, a następnie usuwa mikroporowatą membranę 0,4 mikrona za pomocą sterylnych kleszczyków i umieszcza na płytce Bairda Parkera. Inkubować przez 24 do 48 godzin w temperaturze 35-37 ° C. Technika ta pozwala zliczać typowe kolonie S. aureus.
QA
Do oceny jakości podłoża Baird Parker Agar można wykorzystać znane szczepy, takie jak Staphylococcus aureus ATCC 25923, Staphylococcus aureus ATCC 6538, Staphylococcus epidermidis ATCC 12228, Escherichia coli ATCC 25922 lub Proteus mirabilis ATCC 43071.
W przypadku szczepów S. aureus Wiadomo, że ATCC redukuje telluryn i są one dodatnie pod względem lipazy i lecytynazy. Dlatego musi istnieć zadowalający rozwój i rosnąć wypukłe kolonie z czarnym środkiem i bezbarwną obwódką, z nieprzezroczystym halo i jasną zewnętrzną obwódką..
Ze swojej strony S. epidermidis oczekuje się słabego rozwoju na tym podłożu, z koloniami od brązowoszare do czarnych, bez jasnego halo.
W celu E coli Y P. mirabilis oczekuje się, że zostanie całkowicie lub częściowo zahamowany. W przypadku wzrostu brązowe kolonie rozwiną się bez nieprzezroczystego obszaru lub jasnej otoczki.
zalecenia
-Po dodaniu tellurytu i żółtka nie należy podgrzewać podłoża.
-Przygotowanie emulsji z żółtka jaja i jej dodanie w środku jest bardzo podatnym na zanieczyszczenia etapem. Należy zachować ostrożność.
-Jeśli występują typowe kolonie S. aureus musi zostać potwierdzone przez wykonanie testu koagulazy na wspomnianym szczepie.
-W przypadku wątpliwych wyników z koagulazą należy założyć inne testy potwierdzające.
-Uważaj, aby nie pomylić obecności typowych kolonii S. aureus z nietypowymi czarnymi koloniami.
Bibliografia
- Współtwórcy Wikipedii. Agar Bairda-Parkera. Wikipedia, wolna encyklopedia. 15 marca 2017, 19:36 UTC. Dostępne pod adresem: wikipedia.org/ Dostęp 18 lutego 2019 r.
- BD Laboratories. Baird Parker Agar. 2006. Dostępne na: bd.com
- Britannia Laboratories. Podłoże agarowe Bairda Parkera. 2015 Dostępne pod adresem: britanialab.com
- Francisco Soria Melguizo Laboratories. 2009. Baird Parker Agar. Dostępne pod adresem: http://f-soria.es/Inform
- Britannia Laboratories. Telluryn potasu. 2015 Dostępne pod adresem: britanialab.com
- Alarcón-Lavín M, Oyarzo C, Escudero C, Cerda-Leal F, Valenzuela F. Staphylococcus aureus enterotoksyczne typu A w wymazach z nosogardła u osób mających kontakt z żywnością. Rev Med Chile 2017; 145: 1559-1564
- Venezuelan Standard Covenin 1292-89. (1989). Jedzenie. Izolacja i liczenie Staphylococcus aureus. Dostępne w:sencamer.gob.ve


Jeszcze bez komentarzy