
Formuły, właściwości i zastosowania kwasu hiposiarkowego
Plik kwas podsiarkowy lub kwas ditionawy jest nieznany, nietrwały w czystej postaci, nie istnieje niezależnie i nie został wykryty w roztworze wodnym.
Teoretycznie byłby to stosunkowo słaby kwas, porównywalny z kwasem siarkowym, H2SO3. Znane są tylko jego sole, ditioniny, które są stabilnymi i silnymi reduktorami. Sól sodowa kwasu ditionowego to ditionian sodu.

- Formuły
| kwas ditionowy | anion ditioninowy | ditionian sodu | |
| Formuły | H2S2O4 | S2O42− | Na2S2O4 |
- CAS: 20196-46-7 Kwas podciśnieniowy (lub ditionowy)
- CAS: 14844-07-6 kwas hiposiarawy (lub ditionous, jon)
- CAS: 7775-14-6 ditionian sodu (sól sodowa kwasu ditionawego)
Struktura 2D
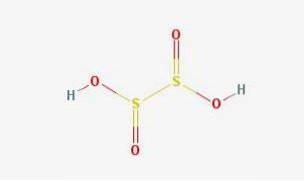
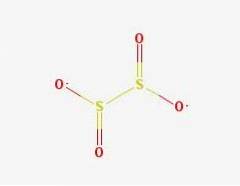
Struktura 3D
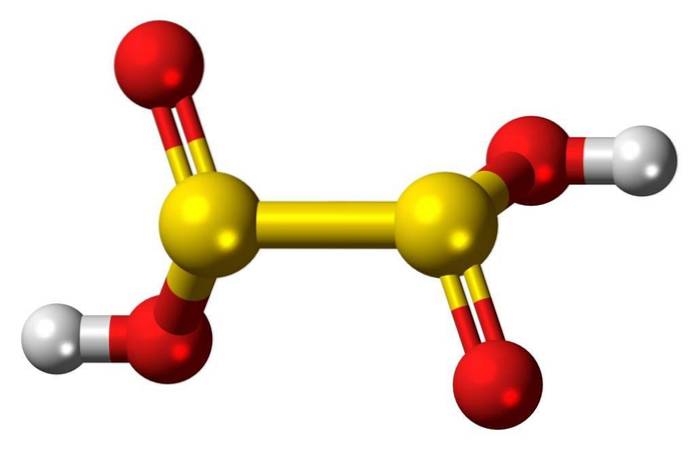
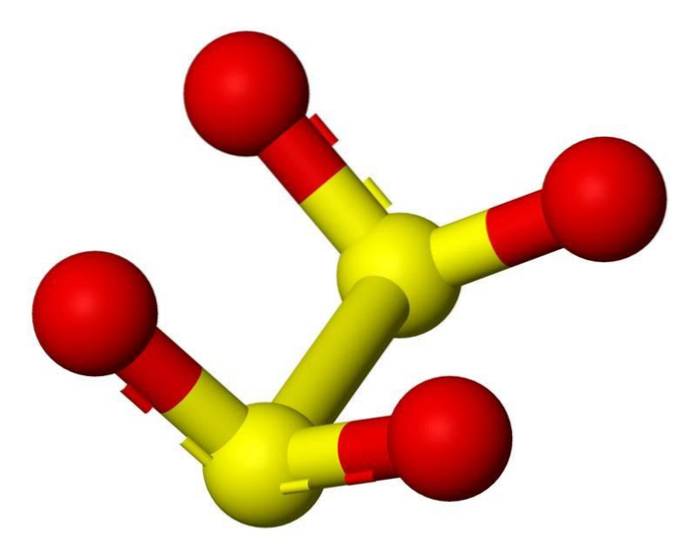
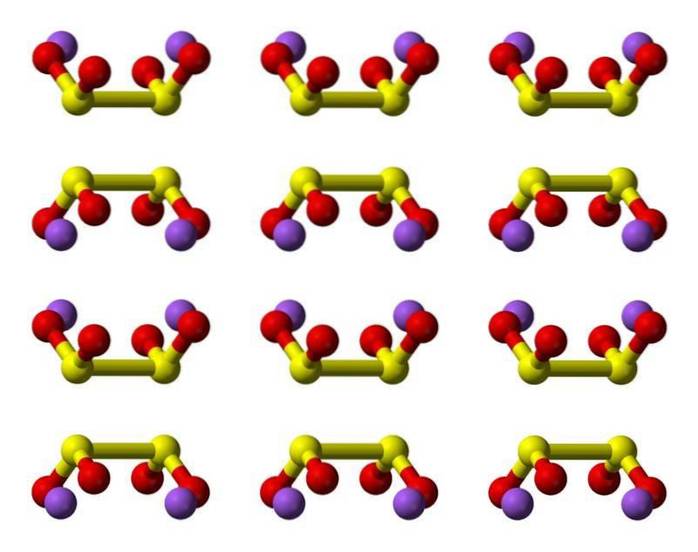
Charakterystyka
Fizyczne i chemiczne właściwości
| kwas ditionowy | anion ditioninowy | ditionian sodu | |
| Wygląd: | . | . | Krystaliczny proszek o barwie białej do białawej |
| . | . | Lekkie płatki cytrynowe | |
| Zapach: | . | . | Słaby zapach siarki |
| Waga molekularna: | 130,132 g / mol | 128,116 g / mol | 174,096 g / mol |
| Temperatura wrzenia: | . | . | Rozkłada się |
| Temperatura topnienia: | . | . | 52 ° C |
| Gęstość: | . | . | 2,38 g / cm3 (bezwodna) |
| Rozpuszczalność w wodzie | . | . | 18,2 g / 100 ml (bezwodna, 20 ° C) |
Kwas hiposiarawy to okso-kwas siarkowy o wzorze chemicznym H2S2O4.
Oksokwasy siarki to związki chemiczne zawierające siarkę, tlen i wodór. Jednak niektóre z nich znane są tylko z ich soli (np. Kwas podsiarkowy, ditionowy, disiarczkowy i siarkowy).
Wśród scharakteryzowanych cech strukturalnych oksokwasów mamy:
- Siarka czworościenna skoordynowana z tlenem
- Mostkowe i końcowe atomy tlenu
- Terminalowe grupy peroxo
- S = zaciski S.
- Ciągi (-S-) n
Kwas siarkowy jest najbardziej znanym oksokwasem siarki i najważniejszym w przemyśle.
Anion ditioninowy ([S2O4] 2-) to oksoanion (jon o wzorze ogólnym AXOY z-) siarki formalnie pochodzący z kwasu ditionowego.
Jony ditionitu ulegają zarówno kwaśnej, jak i zasadowej hydrolizie do odpowiednio tiosiarczanu i wodorosiarczynu oraz siarczynu i siarczku:
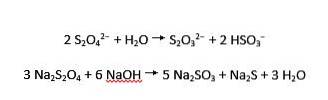
Sól sodowa kwasu ditionawego to ditionian sodu (znany również jako podsiarczyn sodu).
Ditionin sodu jest białawym do jasnożółtego krystalicznym proszkiem o zapachu podobnym do dwutlenku siarki..
Samoistnie nagrzewa się w kontakcie z powietrzem i wilgocią. To ciepło może wystarczyć do zapalenia otaczających materiałów palnych..
W przypadku długotrwałego wystawienia na działanie ognia lub intensywnego ciepła, pojemniki z tym materiałem mogą gwałtownie pęknąć..
Jest stosowany jako środek redukujący i jako środek wybielający. Służy do wybielania masy papierniczej i barwienia. Służy również do redukcji grupy nitrowej do grupy aminowej w reakcjach organicznych..
Chociaż stabilny w większości warunków, rozkłada się w gorącej wodzie i roztworach kwasów.
Można go otrzymać z wodorosiarczynu sodu w następującej reakcji:
2 NaHSO3 + Zn → Na2S2O4 + Zn (OH) ²
Reakcje powietrza i wody
Ditionian sodu to palne ciało stałe, które w kontakcie z wodą lub parą wodną powoli rozkłada się, tworząc tiosiarczany i wodorosiarczyny..
Ta reakcja wytwarza ciepło, które może dodatkowo przyspieszyć reakcję lub spowodować spalenie otaczających materiałów. Jeśli mieszanina jest zamknięta, reakcja rozkładu może skutkować zwiększeniem ciśnienia w pojemniku, które może gwałtownie pęknąć. Pozostając w powietrzu, powoli utlenia się, wytwarzając toksyczny dwutlenek siarki.
Niebezpieczeństwo pożaru
Ditionian sodu jest materiałem łatwopalnym i palnym. Może zapalić się w kontakcie z wilgotnym powietrzem lub wilgocią. Może szybko się palić z efektem flary. Może reagować energicznie lub wybuchowo w kontakcie z wodą.
Może rozkładać się wybuchowo po ogrzaniu lub w kontakcie z ogniem. Po ugaszeniu ognia można go ponownie zapalić. Wyciek może stworzyć zagrożenie pożarem lub wybuchem. Kontenery mogą wybuchnąć po podgrzaniu.
Zagrożenie dla zdrowia
W kontakcie z ogniem ditionian sodu wydziela drażniące, żrące i / lub toksyczne gazy. Wdychanie produktów rozkładu może spowodować poważne obrażenia lub śmierć. Kontakt z substancją może spowodować poważne oparzenia skóry i oczu. Wyciek z urządzeń przeciwpożarowych może powodować zanieczyszczenie.
Aplikacje
Jon ditionianowy jest używany, często w połączeniu ze środkiem kompleksującym (np. Kwasem cytrynowym), do redukcji tlenowodorotlenku żelaza (III) do rozpuszczalnych związków żelaza (II) i usuwania amorficznych faz mineralnych zawierających żelazo (III) w analizie gleby (ekstrakcja selektywna ).
Ditionin zwiększa rozpuszczalność żelaza. Dzięki silnemu powinowactwu jonu ditioninowego do dwuwartościowych i trójwartościowych kationów metali stosowany jest jako środek chelatujący..
W wyniku rozkładu ditionitu powstają zredukowane rodzaje siarki, które mogą być bardzo agresywne dla korozji stali i stali nierdzewnej..
Wśród zastosowań ditionianu sodu mamy:
W przemyśle
Ten związek jest solą rozpuszczalną w wodzie i może być stosowany jako środek redukujący w roztworach wodnych. Jest stosowany jako taki w niektórych przemysłowych procesach barwienia, głównie tych, w których stosuje się barwniki siarkowe i barwniki kadziowe, w których nierozpuszczalny w wodzie barwnik można zredukować do rozpuszczalnej w wodzie soli metalu alkalicznego (na przykład barwnika indygo).
Właściwości redukujące ditionianu sodu usuwają również nadmiar barwnika, resztkowy tlenek i niepożądane pigmenty, poprawiając w ten sposób ogólną jakość koloru..
Ditionian sodu może być również stosowany do uzdatniania wody, oczyszczania gazów, oczyszczania i ekstrakcji. Może być również stosowany w procesach przemysłowych jako środek sulfonujący lub źródło jonów sodu.
Oprócz przemysłu tekstylnego związek ten znajduje zastosowanie w branżach związanych ze skórą, żywnością, polimerami, fotografią i wielu innych. Stosowany również jako środek wybielający w reakcjach organicznych.
W naukach biologicznych
Ditionin sodu jest często stosowany w eksperymentach fizjologicznych jako sposób na zmniejszenie potencjału redoks roztworów..
W naukach geologicznych
Ditionian sodu jest często używany w eksperymentach z zakresu chemii gleby w celu określenia ilości żelaza, które nie jest włączane do pierwotnych minerałów krzemianowych..
Bezpieczeństwo i zagrożenia
Zwroty wskazujące rodzaj zagrożenia Globalnie Zharmonizowanego Systemu Klasyfikacji i Oznakowania Chemikaliów (GHS)
Globalnie Zharmonizowany System Klasyfikacji i Oznakowania Chemikaliów (GHS) to system uzgodniony na szczeblu międzynarodowym, stworzony przez Organizację Narodów Zjednoczonych i zaprojektowany w celu zastąpienia różnych norm klasyfikacji i oznakowania stosowanych w różnych krajach poprzez stosowanie spójnych kryteriów na całym świecie..
Klasy zagrożeń (i odpowiadający im rozdział GHS), normy klasyfikacji i oznakowania oraz zalecenia dotyczące ditionianu sodu są następujące (Europejska Agencja Chemikaliów, 2017; Organizacja Narodów Zjednoczonych, 2015; PubChem, 2017):



Bibliografia
- Benjah-bmm27, (2006). Model kija i kuli jonu ditioninowego [obraz] Odzyskany z wikipedia.org.
- Drozdova, Y., Steudel, R., Hertwig, R. H., Koch, W., & Steiger, T. (1998). Struktury i energie różnych izomerów kwasu ditionowego H2S2O4 i jego anionu HS2O4-1. The Journal of Physical Chemistry A, 102 (6), 990-996. Odzyskany z: mycrandall.ca
- Europejska Agencja Chemikaliów (ECHA). (2017). Podsumowanie klasyfikacji i oznakowania. Zharmonizowana klasyfikacja - załącznik VI do rozporządzenia (WE) nr 1272/2008 (rozporządzenie CLP). Ditionian sodu, podsiarczyn sodu. Pobrane 2 lutego 2017 r. Z: echa.europa.eu
- Jynto (dyskusja), (2011). Kule 3D z kwasem dwuskładnikowym [obraz] Odzyskane z: https://en.wikipedia.org/wiki/Dithionous_acid#/media/File:Dithionous-acid-3D-balls.png
- LHcheM, (2012). Próbka ditionianu sodu [obraz] Źródło: wikipedia.org.
- Mills, B. (2009). Sodium-dithionite-xtal-1992-3D-balls [image] Odzyskane z: wikipedia.org.
- Organizacja Narodów Zjednoczonych (2015). Globalnie Zharmonizowany System Klasyfikacji i Oznakowania Chemikaliów (GHS), wydanie szóste poprawione. Nowy Jork, UE: publikacja ONZ. Odzyskany z: unece.orgl
- Narodowe Centrum Informacji Biotechnologicznej. Baza danych PubChem Compound. (2017). Ditionit. Bethesda, MD, UE: National Library of Medicine. Odzyskany z: pubchem.ncbi.nlm.nih.gov.
- Narodowe Centrum Informacji Biotechnologicznej. Baza danych PubChem Compound. (2017). Kwas ditionowy. Bethesda, MD, UE: National Library of Medicine. Odzyskany z: nih.gov.
- Narodowe Centrum Informacji Biotechnologicznej. Baza danych PubChem Compound. (2017). Ditionian sodu. Bethesda, MD, UE: National Library of Medicine. Odzyskany z: nih.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Arkusz danych chemicznych. Ditionian sodu. Silver Spring, MD. UE; Odzyskany z: cameochemicals.noaa.gov
- PubChem (2016). Dithionite [image] Odzyskane z: nih.gov.
- PubChem (2016). Dithionite [image] Odzyskane z: nih.gov.
- PubChem (2016). Kwas ditionawy [obrazek] Odzyskany z: nih.gov.
- Wikipedia. (2017). Ditionit. Pobrano 2 lutego 2017 r. Z: wikipedia.org.
- Wikipedia. (2017). Dithionous_acid. Pobrano 2 lutego 2017 r. Z: wikipedia.org.
- Wikipedia. (2017). Oxyanion. Pobrano 2 lutego 2017 r. Z: wikipedia.org.
- Wikipedia. (2017). Ditionian sodu. Pobrano 2 lutego 2017 r. Z: wikipedia.org.
- Wikipedia. (2017). Oksokwas siarki. Pobrano 2 lutego 2017 r. Z: wikipedia.org.



Jeszcze bez komentarzy