
Podłoże, przygotowanie i zastosowanie LIA Agar (Lysine Iron)
Plik Agar LIA (Iron Lysine) to test biochemiczny stosowany do identyfikacji bakterii z rodziny Enterobacteriaceae. Medium to zostało stworzone przez Edwardsa i Fife'a w oparciu o formułę Falkowa.
Pierwotnie ten test był bulionem zawierającym peptony, ekstrakt drożdżowy, glukozę, L-lizynę, purpurę bromokrezolową i wodę destylowaną. Edwards i Fife dodali agar-agar, cytrynian amonu żelaza (III) i tiosiarczan sodu..
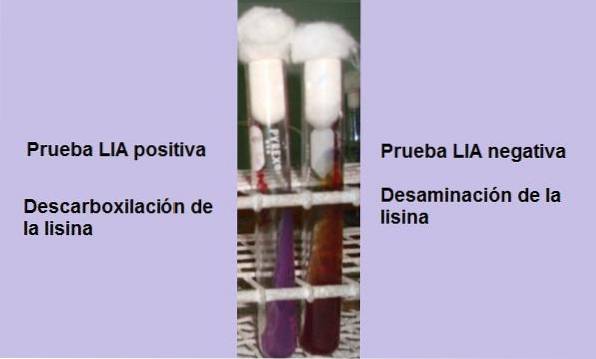
Test zasadniczo polega na wykazaniu obecności enzymu dekarboksylazy lizyny, zdolnego do reagowania z grupą karboksylową aminokwasu L-lizyny. Dezaminacja aminokwasu może również wystąpić z powodu obecności enzymu deaminazy lizynowej..
Ponadto skład podłoża pozwala na wykazanie zdolności niektórych rodzajów bakterii do wytwarzania siarkowodoru. Wreszcie można również zaobserwować wytwarzanie lub brak gazu w ośrodku.
Indeks artykułów
- 1 Uzasadnienie
- 1.1 Peptony i ekstrakt drożdżowy
- 1.2 Glukoza
- 1,3 L-lizyna
- 1,4 wskaźnik pH (purpura bromokrezolowa)
- 1.5 Cytrynian żelazowo-amonowy i tiosiarczan sodu
- 2 Interpretacja testu
- 2.1 Dekarboksylacja lizyny
- 2.2 Deaminacja lizyny
- 2.3 Produkcja siarkowodoru (H2S)
- 3 Zapis wyników
- 4 Przygotowanie
- 5 zastosowań
- 6 Odnośniki
Podstawa
Peptony i ekstrakt drożdżowy
Podobnie jak większość pożywek hodowlanych, agar z lizyną i żelazem zawiera składniki, które stanowią źródło składników odżywczych niezbędnych do wzrostu bakterii. Składniki te reprezentowane są przez peptony i ekstrakt drożdżowy.
Glukoza
Podobnie agar zawiera glukozę jako węglowodan ulegający fermentacji. Wiadomo, że wszystkie bakterie z rodziny Enterobacteriaceae fermentują glukozę.
Ten krok jest kluczowy, ponieważ będzie odpowiedzialny za zakwaszenie pożywki, niezbędny warunek działania enzymu dekarboksylazy lizyny - jeśli jest obecny - na jej substrat..
W niektórych rodzajach bakterii można zaobserwować wytwarzanie gazu w wyniku fermentacji glukozy.
Gaz jest widoczny, gdy następuje przemieszczenie agaru w probówce, pozostawiając pustą przestrzeń na dnie probówki lub przez pęknięcie podłoża na dwie lub więcej porcji.
L-lizyna
Po dekarboksylacji lizyny powstaje diamina (kadaweryna) i dwutlenek węgla.
Dekarboksylacja zachodzi w obecności koenzymu fosforanu pirydoksalu. Ta reakcja jest nieodwracalna.
Wskaźnik pH (fiolet bromokrezolowy)
Wszystkie zmiany pH, które zachodzą w pożywce w wyniku różnych reakcji, są wykrywane przez purpurowy wskaźnik pH bromokrezolu..
W tym sensie, gdy następuje zakwaszenie, podłoże zmienia kolor na żółty, a gdy występuje alkalizacja, powraca do swojego pierwotnego fioletowego lub fioletowego koloru..
Kiedy następuje deaminacja lizyny z powodu obecności enzymu deaminazy lizynowej, na powierzchni tworzy się czerwonawy kolor, typowy dla rodzajów Proteus, Providencia i niektórych gatunków Morganella.
Wynika to z faktu, że podczas procesu deaminacji powstaje kwas alfa-keto-węglowy, który w obecności tlenu reaguje z cytrynianem amonu, powodując wspomniany wcześniej kolor..
Cytrynian żelazowo-amonowy i tiosiarczan sodu
Z drugiej strony, o bakteriach wytwarzających siarkowodór będzie świadczyć obecność tiosiarczanu sodu (źródło siarki) i cytrynianu amonowo-żelazowego, który jest wywoływaczem HdwaS.
Bakterie posiadające enzym reduktazę tiosiarczanową mają zdolność do działania poprzez redukcję obecnego tiosiarczanu sodu, tworząc siarczyn i siarkowodór (HdwaS).
Ten ostatni jest bezbarwnym gazem, ale reagując z solą żelaza tworzy siarczek żelazawy, który jest związkiem nierozpuszczalnym (widoczny czarny osad).
Jednak zdolność formowania H.dwaS w tym podłożu nie jest zbyt wiarygodne, ponieważ niektóre bakterie lizyny dekarboksylazy ujemne są zdolne do wytwarzania H.dwaS nie utworzy czarnego osadu, ponieważ kwasowość podłoża przeszkadza. Dlatego zaleca się sprawdzenie z innymi mediami zawierającymi żelazo.
Interpretacja testu
Dekarboksylacja lizyny
Probówki należy odczytać po 24 godzinach inkubacji, w przeciwnym razie istnieje ryzyko błędnej interpretacji reakcji, zgłaszając fałszywie ujemne wyniki.
Należy pamiętać, że pierwszą reakcją, jaka nastąpi, będzie fermentacja glukozy, dlatego wszystkie probówki po 10-12 godzinach zabarwiają się na żółto..
Jeśli pod koniec czasu inkubacji (24 godziny) obserwuje się żółte tło z fioletową lub fioletową powierzchnią, reakcja jest ujemna. Fioletowy kolor powierzchni odpowiada alkalizacji podłoża przy użyciu peptonów.
Reakcja pozytywna to taka, w której dno i powierzchnia probówki są całkowicie fioletowe, to znaczy wraca do pierwotnego koloru..
Dlatego to, kto decyduje o pozytywności testu, jest podstawą lub tłem medium. W razie wątpliwości co do koloru można go porównać do nieinokulowanej probówki LIA.
Deaminacja lizyny
Rurka wykazująca deaminację lizyną będzie miała czerwonawo-bordową powierzchnię i żółte (kwaśne) tło lub cała rurka będzie miała czerwonawo-bordowy kolor..
Ta reakcja jest interpretowana jako negatywna dla dekarboksylacji lizyny, ale pozytywna dla deaminacji lizyny..
Ta reakcja jest zdefiniowana i zinterpretowana na ramce.
Produkcja siarkowodoru (H.dwaS)
Pozytywną reakcję obserwuje się po pojawieniu się czarnego osadu w całości lub w części pożywki. Zwykle między krawędzią skosu a podstawą.
Jeśli osad pojawi się w całej rurce, nie pokaże innych reakcji, które zachodzą w środku..
Zapis wyników
Podczas interpretacji testu wyniki zapisuje się w następujący sposób:
Ramka jest czytana jako pierwsza, następnie dół lub blok, a następnie produkcja H.dwaTak, i wreszcie produkcja gazu.
Przykład: K / A + (-). To znaczy:
- K: luneta alkaliczna (kolor fioletowy)
- A: Tło kwasowe (żółte), tj. Ujemna reakcja dekarboksylacji i ujemna deaminacja.
- +: Produkcja siarkowodoru
- (-): Bez gazu.
Przygotowanie
Odważyć 35 g odwodnionego podłoża agarowego z lizyną i rozpuścić w jednym litrze wody destylowanej..
Podgrzewaj, aż agar całkowicie się rozpuści, w tym celu gotuj przez minutę, często mieszając. Rozprowadzić 4 ml pożywki do probówek 13/100 z bawełnianymi zatyczkami.
Sterylizuj w autoklawie w 121 ° C przez 15 minut. Wyjąć z autoklawu i odstawić pod kątem, tak aby była głęboka podstawa i krótki skos.
Przechowywać w lodówce 2-8 ° C. Pozostaw do ogrzania przed wysianiem szczepu bakteryjnego.
Odwodnione podłoże jest beżowe, a przygotowane podłoże jest czerwonawo-fioletowe..
Końcowe pH przygotowanej pożywki wynosi 6,7 ± 0,2
Pożywka zmienia kolor na żółty przy pH równym lub niższym niż 5,2 i jest purpurowy przy pH 6,5 i większym.
Aplikacje
Ten test, wraz z innymi testami biochemicznymi, służy do identyfikacji pałeczek z rodziny Enterobacteriaceae..
Pożywkę wysiewa się za pomocą prostej pętli lub igły, wykonuje się jedno lub dwa nakłucia na dnie probówki, a następnie powierzchnię podłoża nacina się zygzakiem..
Inkubować przez 24 godziny w temperaturze 35-37 ° C w warunkach tlenowych. W razie potrzeby inkubować przez kolejne 24 godziny..
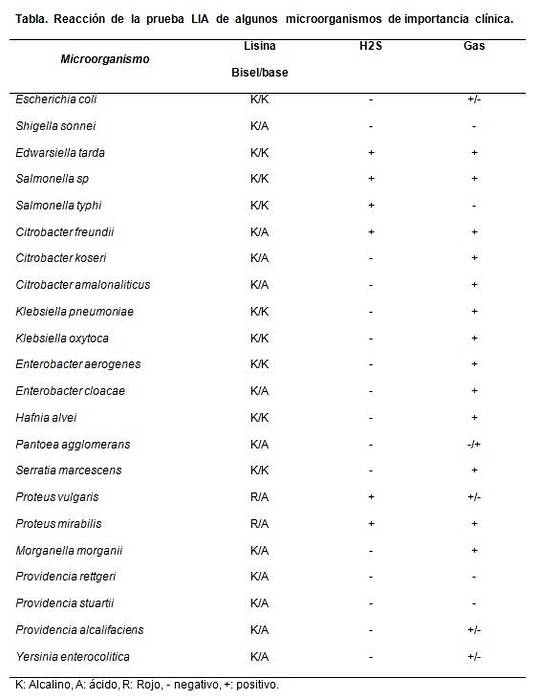
Przydatne jest przede wszystkim do odróżnienia laktozo-ujemnych gatunków Citrobacter od Salmonellas sp.
Bibliografia
- Mac Faddin J. (2003). Testy biochemiczne do identyfikacji bakterii o znaczeniu klinicznym. 3rd ed. Od redakcji Panamericana. Buenos Aires. Argentyna.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnoza mikrobiologiczna Bailey & Scott. 12 ed. Od redakcji Panamericana S.A. Argentyna.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnoza mikrobiologiczna. 5th ed. Od redakcji Panamericana S.A. Argentyna.
- Britannia Laboratories. Agar lizynowo-żelazowy. 2015 Dostępne pod adresem: britanialab.com
- BD Laboratories. BBL Lysine Iron Agar Slants. 2007. Dostępne pod adresem: bd.com
- Valtek Laboratories. Bliski L.I.A. 2009 Dostępne pod adresem: andinamedica.com



Jeszcze bez komentarzy