
Właściwości, reaktywność i zastosowania wodorku wapnia (CaH2)

Plik wodorek wapnia Jest to związek chemiczny o wzorze CaH2, dzięki czemu jest wodorem metali ziem alkalicznych. Ten związek chemiczny ma dwa wiązania jonowe między wapniem a dwoma jonami wodorkowymi, jak pokazano na rysunku 1.
Jest solą wodorkową, co oznacza, że ma budowę zbliżoną do soli. Jego struktura krystaliczna jest taka sama jak w przypadku chlorku ołowiu (minerału kotunitu), jak pokazano na rysunku 2.
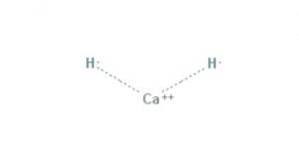
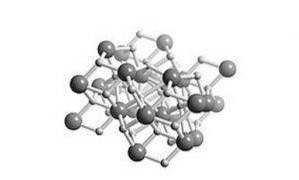
Wszystkie metale alkaliczne i ziem alkalicznych tworzą sole wodorkowe. W chemii wodorek jest anionem wodoru, H- lub częściej jest to związek, w którym jedno lub więcej centrów wodoru ma właściwości nukleofilowe, redukujące lub zasadowe.
W związkach, które są uważane za wodorki, atom wodoru jest przyłączony do bardziej elektrododatniego pierwiastka lub grupy.
Można go wytwarzać w reakcji wapnia i wodoru w temperaturze od 300 do 400 stopni Celsjusza. Innym sposobem przygotowania wodorku wapnia jest ogrzewanie chlorku wapnia razem z wodorem i metalicznym sodem. Reakcja przebiega następująco:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
W tej reakcji wapń (Ca) i wodór (H) tworzą cząsteczkę wodorku wapnia, a atomy sodu razem z chlorem tworzą cząsteczki chlorku sodu (NaCl)..
Wodorek wapnia można również wytwarzać poprzez redukcję tlenku wapnia (CaO) za pomocą magnezu (Mg). Reakcję prowadzi się w obecności wodoru. W tej reakcji powstaje również tlenek magnezu (MgO). Poniżej znajduje się wzór tej reakcji chemicznej:
CaO + Mg + H2 → CaH2 + MgO
Indeks artykułów
- 1 Właściwości fizyczne i chemiczne wodorku wapnia
- 2 Reaktywność i zagrożenia
- 3 Transport i przechowywanie
- 4 Zastosowania i aplikacje
- 4.1 Środek pochłaniający wilgoć
- 4.2 Produkcja wodoru
- 4.3 Środek redukujący
- 5 Wada stosowania wodorku wapnia
- 6 Odnośniki
Właściwości fizyczne i chemiczne wodorku wapnia
Wodorek wapnia to zbiór kryształów o rombowej strukturze o białym kolorze, gdy jest czysty. Ogólnie rzecz biorąc, rzadko można go znaleźć w tej formie, więc zwykle ma szarawy odcień. Brakuje charakterystycznego zapachu. Jego wygląd pokazano na rysunku 3 (Royal Society of Chemistry, 2015).

Ma masę cząsteczkową 42,094 g / mol, temperaturę topnienia 816 stopni Celsjusza i gęstość 1,70 g / ml. Jeśli rozpuszcza się w wodzie, reaguje gwałtownie, wytwarzając wodór. Reaguje również z alkoholem (National Center for Biotechnology Information., S.F.).
Reaktywność i zagrożenia
Wodorek wapnia jest stabilną substancją chemiczną, chociaż silnie reaguje z wodą lub wilgocią. W kontakcie z wodą uwalnia łatwopalny wodór, który może ulec samozapaleniu.
Uważa się, że jest to związek wybuchowy. Ogrzany w reakcji z tetrahydrofuranem może spowodować wybuch. Po zmieszaniu z chloranem, podchlorynem, bromianem, nadchloranem potasu staje się wrażliwy na ciepło, tarcie i staje się wybuchowy (wodorek wapnia 7789-78-8, 2016).
Gdy fluorek srebra zostanie zmiażdżony wodorkiem wapnia, masa staje się żarząca. Silne ogrzewanie wodorku chlorem, bromem lub jodem prowadzi do żarzenia.
Mieszaniny wodorku z różnymi bromianami, na przykład bromianem lub chloranami baru, na przykład chloranem baru i nadchloranami, takimi jak nadchloran potasu, eksplodują podczas mielenia. CaH2 reaguje żarząco z fluorkiem srebra, jeśli jest narażony na tarcie.
Z tym związkiem należy obchodzić się w obojętnej atmosferze. W przypadku niewłaściwego obchodzenia się z nim może stanowić poważne zagrożenie dla zdrowia i bezpieczeństwa personelu laboratoryjnego, ratowników i osób zajmujących się odpadami chemicznymi (Centrum Bezpieczeństwa Laboratoriów UC, 2013).
Niezwykle niebezpieczny w przypadku kontaktu ze skórą lub oczami, ponieważ działa drażniąco. Bardzo niebezpieczne w przypadku kontaktu ze skórą, ponieważ może powodować korozję.
Jest również niebezpieczny w przypadku połknięcia i wdychania. Wielkość uszkodzenia tkanki zależy od długości kontaktu. Kontakt z oczami może spowodować uszkodzenie rogówki lub ślepotę..
Kontakt ze skórą może powodować stan zapalny i pęcherze. Wdychanie pyłu powoduje podrażnienie przewodu pokarmowego lub dróg oddechowych, objawiające się pieczeniem, kichaniem i kaszlem..
Poważne nadmierne narażenie może prowadzić do uszkodzenia płuc, uduszenia, utraty przytomności, a nawet śmierci. Zapalenie oka charakteryzuje się zaczerwienieniem, łzawieniem i swędzeniem. Zapalenie skóry charakteryzuje się swędzeniem, łuszczeniem się, zaczerwienieniem lub czasami powstawaniem pęcherzy.
Powtarzające się narażenie oczu na niski poziom może powodować podrażnienie oczu. Powtarzające się narażenie skóry może spowodować miejscowe zniszczenie skóry lub zapalenie skóry..
Powtarzające się wdychanie pyłu może powodować podrażnienie dróg oddechowych lub uszkodzenie płuc w różnym stopniu. Powtarzające się lub długotrwałe wdychanie pyłu może powodować chroniczne podrażnienie dróg oddechowych (Karta charakterystyki substancji niebezpiecznej Wodorek wapnia MSDS, 2005).
W przypadku kontaktu z oczami należy je natychmiast przepłukać dużą ilością wody przez co najmniej 15 minut, od czasu do czasu unosząc górne i dolne powieki..
W przypadku kontaktu ze skórą natychmiast spłukać dużą ilością wody przez co najmniej 15 minut, zdjąć skażone ubranie i buty..
W przypadku połknięcia nie należy wywoływać wymiotów. Należy wezwać centrum kontroli zatruć. Wskazane jest natychmiastowe opuszczenie miejsca ekspozycji i wyprowadzenie na świeże powietrze.
W przypadku wdychania, jeśli oddychanie jest utrudnione, konieczne jest dostarczenie tlenu. Nie należy przeprowadzać resuscytacji usta-usta, jeśli ofiara połknęła lub wdychała substancję..
Sztuczne oddychanie należy wywoływać za pomocą maski kieszonkowej wyposażonej w zawór jednokierunkowy lub innego odpowiedniego urządzenia medycznego do oddychania. We wszystkich przypadkach należy natychmiast uzyskać pomoc lekarską..
Obsługa i przechowywanie
Preparat należy przechowywać w suchym pojemniku z dala od ciepła. Powinien być trzymany z dala od źródeł zapłonu. Nie należy wdychać pyłu. Do tego produktu nie należy dodawać wody
W przypadku niedostatecznej wentylacji nosić odpowiedni sprzęt do oddychania, taki jak maska filtrująca. W przypadku narażenia zasięgnąć porady lekarza i, jeśli to możliwe, pokazać etykietę. Unikaj kontaktu ze skórą i oczami.
Ogólnie materiały łatwopalne powinny być przechowywane w oddzielnej szafie bezpieczeństwa lub pomieszczeniu magazynowym. Przechowywać pojemnik szczelnie zamknięty.
Przechowywać w chłodnym i dobrze wentylowanym miejscu. Cały sprzęt zawierający materiał musi być uziemiony, aby uniknąć iskier elektrycznych. Pojemnik należy przechowywać w suchym i chłodnym miejscu.
Jest to materiał niepalny. Jednak strażacy powinni nosić odpowiedni sprzęt podczas gaszenia pożaru wokół tego związku chemicznego..
Nigdy nie zaleca się stosowania wody do gaszenia pożaru wokół wodorku wapnia. W tym celu można zastosować suchy piasek, a także związki takie jak chlorek sodu i węglan sodu..
Aby usunąć odpadowy wodorek wapnia, należy go rozłożyć, dodając 25 ml metanolu na każdy gram wodorku w atmosferze azotu podczas mieszania..
Po zakończeniu reakcji taką samą objętość wody dodaje się do wodnego związku metanolanu wapnia i usuwa do kanalizacji z dużą ilością wody (krajowa rada badawcza, 1995).
Zastosowania i aplikacje
Środek pochłaniający wilgoć
Wodorek potasu jest stosunkowo łagodnym środkiem osuszającym. Z tego powodu stosowanie tego związku jako osuszacza jest bezpieczniejsze w porównaniu z bardziej reaktywnymi środkami, takimi jak stopy sodowo-potasowe i sodowe. Reaguje z wodą w następujący sposób:
CaH2 + 2 H2O → Ca (OH) 2 + 2 H2
Produkty hydrolizy tej reakcji, wodór (gaz) i Ca (OH) 2 (mieszanina wodna), można oddzielić od rozpuszczalnika chemicznego po procesie filtracji, destylacji lub dekantacji..
Ten związek chemiczny jest skutecznym środkiem osuszającym dla wielu podstawowych rozpuszczalników, takich jak aminy i pirydyna. Czasami używany do wstępnego suszenia rozpuszczalników przed zastosowaniem bardziej reaktywnych środków osuszających.
Produkcja wodoru
W latach czterdziestych XX wieku związek ten był dostępny jako źródło wodoru pod nazwą handlową „Hydrolith”..
Od dawna jest używany jako źródło wodoru. Nadal jest używany do produkcji czystego wodoru w laboratoriach do różnych eksperymentów, zaawansowanych ogniw paliwowych i zastosowań w akumulatorach (American Elements, S.F.).
Związek od dziesięcioleci jest szeroko stosowany jako bezpieczny i wygodny sposób nadmuchiwania balonów pogodowych..
Jest również regularnie używany w laboratoriach do produkcji niewielkich ilości bardzo czystego wodoru do eksperymentów. Wilgotność oleju napędowego oblicza się na podstawie wodoru powstającego po obróbce CaH2.
Środek redukujący
Po podgrzaniu od 600 do 1000 stopni Celsjusza tlenek cyrkonu, niob, uran, chrom, tytan, wanad i tantal można zredukować w celu przygotowania proszku tych metali, dzięki czemu wodorek wapnia może być stosowany w metalurgii pyłu.
Poniższa reakcja ilustruje, jak wodorek wapnia działa jako środek redukujący:
TiO + 2CaH2 → CaO + H2 + Ti
Wada w stosowaniu wodorku wapnia
Ten związek chemiczny jest często preferowanym środkiem suszącym; Ma jednak również wady:
-Suszenie tego związku jest powolne, ponieważ nie rozpuszcza się on w żadnym rozpuszczalniku, z którym nie reaguje gwałtownie..
-Ten sproszkowany związek jest niekompatybilny z wieloma rozpuszczalnikami. Jego reakcja z chlorowęglowodorami może nawet spowodować wybuch.
-Nie można go używać do odtleniania rozpuszczalników, ponieważ nie jest w stanie usunąć rozpuszczonego tlenu.
-Rozróżnienie między wodorotlenkiem wapnia i wodorotlenkiem wapnia jest dość trudne ze względu na ich podobny wygląd.
Bibliografia
- Elementy amerykańskie. (S.F.). wodorek wapnia. Pobrane z americanelements.com: americanelements.com.
- Wodorek wapnia 7789-78-8. (2016). Pobrane z chemicalbook.com: chemicalbook.com.
- wodorek wapnia. (s.f.). Źródło od osoby uczącej się chemii: chemistrylearner.com.
- Karta charakterystyki materiału MSDS wodorku wapnia. (2005, 10 października). Pobrane z sciencelab.com: sciencelab.com.
- Narodowe Centrum Informacji Biotechnologicznej. (S.F.). Baza danych PubChem Compound; CID = 105052. Pobrane z pubchem.ncbi.nlm.nih.gov: pubchem.ncbi.nlm.nih.gov.
- krajowa rada ds. badań. (1995). Ostrożne praktyki w laboratorium: postępowanie z chemikaliami i ich usuwanie. Washinton: NationalAacademy Press.
- Królewskie Towarzystwo Chemii. (2015). wodorek wapnia, ID 94784. Pobrane z chemspider.com: chemspider.com.
- Centrum UC dla bezpieczeństwa laboratoryjnego. (18 stycznia 2013). standardowa procedura operacyjna wodorek wapnia. Pobrane z chemengr.ucsb.edu: chemengr.ucsb.edu.



Jeszcze bez komentarzy