
Uzasadnienie, przygotowanie i zastosowania agaru XLD
Plik Agar XLD lub Agar z dezoksycholanem ksylozy i lizyny jest selektywną i zróżnicowaną stałą pożywką hodowlaną do izolacji enteropatogenów. Taylor zaprojektował formułę agaru XL (ksyloza, lizyna), aby poprawić izolację rodzaju Shigella.
Zauważył, że ten rodzaj był hamowany w większości pożywek przeznaczonych do izolacji enteropatogenów. Następnie dodano dezoksycholan sodu, tiosiarczan sodu i cytrynian żelazowo-amonowy w celu zwiększenia jego selektywności. Ta formuła okazała się przydatna zarówno w izolacji Shigella, jak i Salmonella.
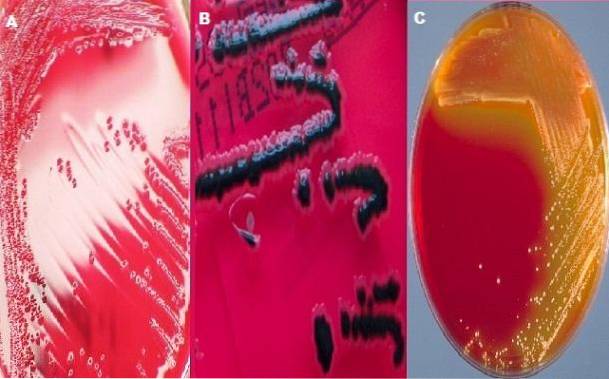
Agar XLD składa się z ekstraktu drożdżowego, dezoksycholanu sodu, ksylozy, lizyny, laktozy, sacharozy, tiosiarczanu sodu, cytrynianu amonu żelazowego, chlorku sodu, czerwieni fenolowej i agaru. W większości laboratoriów bakteriologicznych do badania próbek kału pod kątem Shigella i Salmonella stosuje się agar duo XLD i agar SS..
Inne laboratoria, wśród innych dostępnych opcji, preferują połączenie agaru CHROMagar Salmonella i agaru XLD. Te duety można przygotować na podwójnych szalkach Petriego. Po jednej stronie umieszczają agar XLD, a po przeciwnej stronie wybrane podłoże.
Indeks artykułów
- 1 Uzasadnienie
- 1.1 - Odżywcza moc
- 1.2 -Selektywność medium
- 1.3 -Różnicowa moc
- 1,4 -chlorek sodu, agar i czerwień fenolowa
- 2 Przygotowanie
- 3 Zastosowania
- 3.1 Rodzaje próbek
- 3.2 Warunki siewu i identyfikacji
- 4 Kontrola jakości
- 5 Uwagi końcowe
- 6 Odnośniki
Podstawa
-Odżywcza moc
Agar XLD zawiera ekstrakt drożdżowy, który służy jako źródło składników odżywczych dla mikroorganizmów rozwijających się na tym agarze. Dodatkowo obecność węglowodanów (ksylozy, sacharozy i laktozy) dostarcza bakteriom energii, które mogą je fermentować.
-Selektywność medium
Jako substancja hamująca zawiera dezoksycholan sodu; Zapobiega to rozwojowi bakterii Gram-dodatnich, czyniąc podłoże selektywnym.
-Moc różnicowa
Typowe kolonie Shigella
Jak już wspomniano, agar XLD zawiera ksylozę; Ten węglowodan jest fermentowany przez wszystkie bakterie, które rosną w tym podłożu, z wyjątkiem rodzaju Shigella..
Jest to jedna z cech, która nadaje mu zróżnicowany charakter, ponieważ kolonie Shigella różnią się od reszty tworzeniem czerwonych kolonii, podczas gdy inne bakterie wytwarzają żółte kolonie..
Typowe kolonie Salmonelli
Rodzaj Salmonella również fermentuje ksylozę, początkowo tworząc żółte kolonie. Jednak po wyczerpaniu ksylozy węglowodanowej atakuje lizynę ze względu na jej enzym dekarboksylazę lizynową. Dekarboksylacja lizyny generuje alkalia, które zmieniają kolor kolonii i otaczającego podłoża na oryginalny czerwony.
Takie zachowanie jest wywoływane tylko przez Salmonellę, ponieważ bakterie z grupy coli, które dekarboksylują lizynę, nie są w stanie alkalizować pożywki. Dzieje się tak, ponieważ bakterie z grupy coli również fermentują obecną laktozę i sacharozę; w związku z tym produkcja kwasów jest bardzo wysoka, pozostawiając żółtą kolonię w tych bakteriach.
Należy zauważyć, że rodzaj Salmonella nie powoduje fermentacji sacharozy ani laktozy.
Produkcja H.dwaS
Agar XLD umożliwia również wykrycie gatunków Salmonella, które wytwarzają H.dwaS; W tym celu ma źródło siarki reprezentowane przez tiosiarczan sodu i wywoływacz reakcji, którym jest cytrynian amonowo-żelazowy..
Ten ostatni reaguje z H.dwaS (bezbarwny gaz) i tworzy nierozpuszczalny, widoczny czarny osad siarczanu żelaza. W tym sensie cechy charakterystyczne kolonii salmonelli będą czerwone z czarnym środkiem..
Należy zauważyć, że w przypadku reakcji tworzenia się HdwaTak, potrzebne jest zasadowe pH. Dlatego inne Enterobacteriaceae tworzące H.dwaS nie mogą tego zrobić lub robią to słabo w tym podłożu, ponieważ wysoka kwasowość, którą wytwarzają podczas fermentacji obecnych węglowodanów, hamuje lub utrudnia reakcję.
-Chlorek sodu, agar i czerwień fenolowa
Wreszcie chlorek sodu utrzymuje równowagę osmotyczną; agar jest czynnikiem zestalającym, a czerwień fenolowa wykrywa zmiany pH, zmieniając kolor kolonii i podłoża.
Przygotowanie
Odważyć 55 g odwodnionej pożywki XLD i rozpuścić w 1 litrze wody. Ogrzać i mieszać mieszaninę, aż osiągnie temperaturę wrzenia. Nie przegrzewać, ponieważ ciepło uszkadza podłoże i tworzy osad, który zmienia morfologię typowych kolonii.
To podłoże nie może być sterylizowane w autoklawie. Podczas rozpuszczania należy go przenieść do łaźni wodnej o temperaturze 50 ° C. Po schłodzeniu należy podawać bezpośrednio na sterylne szalki Petriego. Można je wylewać na pojedyncze talerze lub podwójne talerze. Pozostawia się je do zestalenia i przechowuje w lodówce do czasu użycia..
Odpuszczać przed użyciem. Ze względu na to, że jest to podłoże niesterylne, zaleca się przygotowanie go przed datą jego użycia..
Końcowe pH pożywki powinno wynosić 7,4 ± 0,2. Kolor przygotowanego podłoża jest pomarańczowo-czerwony, półprzezroczysty, bez osadu..
Jeśli masz podstawowy agar z ksylozą i lizyną (XL), możesz dodać dezoksycholan sodu, tiosiarczan sodu i cytrynian amonu żelaza. W ten sposób uzyskuje się formułę agaru XLD.
Aplikacje
Agar XLD służy do odzyskiwania enteropatogenów, głównie z rodzaju Shigella i wtórnie z rodzaju Salmonella. Jest to przydatne do oceny próbek kału, wody i pokarmu.
Rodzaje próbek
Kał
Próbki kału można wysiewać bezpośrednio na agarze XLD, zapewniając dobrą dystrybucję materiału w celu uzyskania izolowanych kolonii.
Aby poprawić regenerację Salmonelli, agar XLD można wysiewać z pożywki wzbogacającej Salmonella..
jedzenie
W przypadku żywności można stosować buliony wzbogacające Salmonella i Shigella. W przypadku Salmonelli można użyć m.in. bulionu seleninowo-cystynowego, jasnozielonego bulionu tetrationianowego..
W przypadku Shigella można ją wzbogacić bulionem Shigella z 0,5 µ / ml nowobiocyny, inkubować w temperaturze 42 ° ± 1 ° C przez 16-20 godzin.
woda
W analizie wody zaleca się między innymi technikę filtracji membranowej oraz użycie agaru XLD..
Warunki siewu i identyfikacji
Zaszczepione podłoże inkubuje się w warunkach tlenowych w temperaturze 35 ° C przez 24 do 48 godzin..
Obserwuje się typowe kolonie każdego rodzaju, podejrzane kolonie należy poddać testom biochemicznym w celu ich identyfikacji.
QA
Do oceny kontroli jakości pożywki można użyć następujących szczepów bakterii: Salmonella typhimurium ATCC 14028, Salmonella enteritidis ATCC 13076, Abony Salmonella DSM 4224, Shigella flexneri ATCC 12022, Shigella sonnei ATCC 25931, Escherichia coli ATCC 25922, Proteus mirabilis ATCC 43071, Klebsiella pneumoniae ATCC 33495.
Rodzaj Salmonella charakteryzuje się występowaniem w tej pożywce czerwonych kolonii z czarnym środkiem lub całkowicie czarnych kolonii. Natomiast w rodzaju Shigella kolonie muszą być czerwone, czyli kolor podłoża.
W przypadku Escherichia coli oczekuje się, że zostanie całkowicie lub częściowo zahamowany; jeśli rośnie, kolonie są żółte. W celu Proteus mirabilis spodziewany jest słaby wzrost w przypadku kolonii różowych z lub bez czarnego środka. Ostatecznie rodzaj Klebsiella wyrośnie jako żółte kolonie.
Końcowe przemyślenia
Agar XLD jest szeroko stosowany w laboratoriach bakteriologicznych ze względu na jego wysoką skuteczność w odzyskiwaniu Shigella, a także ma dobrą regenerację rodzaju Salmonella.
Rall i wsp. (2005) w swojej pracy zatytułowanej „Ocena trzech bulionów wzbogacających i pięciu stałych pożywek do wykrywania Salmonelli u drobiu” wykazali, że z 3 klasycznych badanych podłoży (jasnozielony agar, agar SS i agar XLD) agar miał najlepszy współczynnik odzysku.
Odsetki odzysku były następujące: 13,8% dla jasnozielonego agaru, 27,6% dla SS i 34,5% dla XLD. Został on przekroczony jedynie przez podłoże chromogenne Rambach agar z 48% odzyskiem i CHROMagar z 79,3%.
Bibliografia
- Choroby pokarmowe. Shigellosis. Dostępne pod adresem: anmat.gov.ar
- „Agar XLD”. Wikipedia, wolna encyklopedia. 9 lutego 2019 r., 11:46 UTC. 10 kwietnia 2019, 19:25 wikipedia.org
- BBL Laboratories. CHROMagar Salmonella / BD XLD Agar (biplate). 2013 Dostępne na: bd.com
- Lab. Neogen. Agar XLD. Dostępne pod adresem: foodsafety.neogen
- Laboratorium Francisco Soria Melguizo. Agar XLD. Dostępne pod adresem: http://f-soria.es/Inform
- Rall L, Rall R, Aragon C, Silva M.Ocena trzech bulionów do wzbogacania i pięciu podłoży do wykrywania salmonelli u drobiu. Braz. J. Microbiol. 2005; 36 (2): 147–150. Dostępne pod adresem: scielo.br
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnoza mikrobiologiczna Bailey & Scott. 12 ed. Od redakcji Panamericana S.A. Argentyna.


Jeszcze bez komentarzy