
Alotropy węgla węgiel amorficzny, grafit, grafeny, nanorurki

Plik alotropy węgla są to różne formy fizyczne, w których ich atomy mogą być ułożone i połączone. Każdy z nich odpowiada bryle z własnymi specjalnymi cechami. Różnią się one od siebie pod względem molekularnym i strukturalnym. Istnieją dwa główne typy tych alotropów: krystaliczne i bezpostaciowe..
Krystaliczne alotropy to te, które mają powtarzający się wzór swoich atomów w przestrzeni. Tymczasem w amorficznych alotropach atomy są rozmieszczone nieuporządkowany, bez dwóch identycznych regionów w ciele stałym. Tak więc pierwsze są uporządkowane, a drugie niechlujne.
(https://creativecommons.org/licenses/by-sa/4.0)]
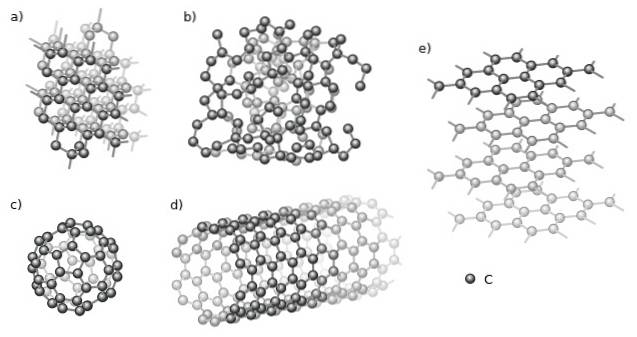
Wśród krystalicznych są diament (a) i grafit (e) par excellence. Na górnym obrazie widać różne struktury, które mają wspólny aspekt: składają się tylko z atomów węgla (czarne kule).
A wśród amorficznych alotropów mamy amorficzny węgiel (b), który, jak widać, ma nieuporządkowaną strukturę. Jednak istnieje wiele rodzajów węgli amorficznych, więc jest to rodzina ciał stałych..
Ponadto atomy węgla mogą tworzyć supramolekuły, takie jak fulereny (c) i nanorurki (d). Te supramolekuły mogą różnić się rozmiarem i kształtem, ale zachowują tę samą geometrię; sferyczne i rurowe odpowiednio dla fulerenów i nanorurek.
Indeks artykułów
- 1 Wiązania kowalencyjne węgla
- 1.1 Sześciokąty
- 1.2 Czworościany
- 2 Amorficzny węgiel
- 2.1 Politalizm
- 2.2 Grupy funkcjonalne
- 3 Grafit
- 3.1 Właściwości fizyczne
- 4 Grafeny
- 5 nanorurek węglowych
- 5.1 Konformacje strukturalne
- 6 Fulererenów
- 7 Referencje
Wiązania kowalencyjne węgla
Zanim zajmiemy się niektórymi ze znanych alotropów węgla, konieczne jest przeanalizowanie sposobu wiązania atomów węgla..
Zgodnie z teorią wiązań walencyjnych węgiel ma w swojej powłoce walencyjnej cztery elektrony, z którymi tworzą wiązania kowalencyjne. Dzięki elektronicznej promocji i hybrydyzacji cztery elektrony można umieścić na czterech oddzielnych orbitaliach, czy to czystych, czy hybrydowych.
Dlatego węgiel ma zdolność tworzenia maksymalnie czterech wiązań.
DC. Dzięki czterem wiązaniom C-C atomy docierają do oktetu walencyjnego i stają się bardzo stabilne. Nie oznacza to jednak, że nie mogą istnieć tylko trzy takie linki, takie jak te widoczne w sześciokątach..
Sześciokąty
W zależności od hybrydyzacji atomu węgla, podwójne lub potrójne wiązania można znaleźć w strukturze ich odpowiednich alotropów. Ale nawet bardziej oczywista niż istnienie takich wiązań jest geometria, którą przyjmują węgle.
Na przykład, jeśli obserwuje się sześciokąt, oznacza to, że węgle mają hybrydyzację spdwa i dlatego mają orbital p czysty z samotnym elektronem. Czy na pierwszym obrazku widać idealne sześciokąty? Te alotropy, które je zawierają, sugerują, że ich węgle są spdwa, czy występują wiązania podwójne (takie jak te z pierścienia benzenowego).
Siatka, warstwa płaska lub heksagonalna składa się wówczas z węgla spdwa który ma elektroniczny „sufit” lub „chmurę”, będący produktem niesparowanego elektronu orbity p. Ten elektron może tworzyć wiązania kowalencyjne z innymi cząsteczkami lub przyciągać dodatnie ładunki jonów metali; jak K+ i Na+.
Podobnie, te elektrony pozwalają tym powłokom układać się jedna na drugiej, bez wiązania (ze względu na geometryczną i przestrzenną przeszkodę w nakładaniu się dwóch orbitali p). Oznacza to, że alotropy o geometrii sześciokątnej mogą, ale nie muszą, zostać zamówione do budowy kryształu..
Czworościany
Jeśli obserwuje się czworościan, jak zostanie wyjaśnione w ostatniej sekcji, oznacza to, że węgle mają hybrydyzację sp3. W nich są cztery pojedyncze wiązania C-C, które tworzą czworościenną sieć krystaliczną. W takich czworościanach nie ma wolnych elektronów, jak w sześciokątach..
Węgiel amorficzny

Amorficzny węgiel można sobie wyobrazić jako rodzaj porowatej gąbki z wieloma arbitralnie ułożonymi sieciami heksagonalnymi i czworościennymi. W tej mineralnej matrycy mogą uwięzić inne elementy, które mogą zagęścić lub rozszerzyć wspomnianą gąbkę; w ten sam sposób jego jądra strukturalne mogą być większe lub mniejsze.
Zatem, w zależności od% węgla, otrzymywane są różne typy amorficznych węgli; takie jak sadza, węgiel drzewny, antracyt, sadza, torf, koks i węgiel aktywny.
Na pierwszy rzut oka wszystkie wyglądają podobnie (górne zdjęcie), z gradacjami do krawędzi czarnych, matowych lub metalicznych i szarawych odcieni..
Nie wszystkie amorficzne węgle mają to samo pochodzenie. Węgiel roślinny, jak sama nazwa wskazuje, jest produktem spalania mas roślinnych i drewna. Natomiast sadza i koks to produkty na różnych etapach i warunkach procesów naftowych..
Chociaż nie wydają się one zbyt atrakcyjne i można sądzić, że służą jedynie jako paliwa, porowatość ich ciał stałych przyciąga uwagę w technologicznych zastosowaniach oczyszczania, takich jak absorbenty i magazynowanie substancji, a także jako nośniki katalityczne..
Politypizm
Struktury amorficznych węgli są złożone i nieuporządkowane; ale badania krystalograficzne wykazały, że w rzeczywistości są to polipy czworościenne (diament) i heksagonalne (grafit), ułożone dowolnie w warstwach.
Na przykład, jeśli T i H są odpowiednio warstwami czworościenną i heksagonalną, wówczas amorficzny węgiel można strukturalnie opisać jako: THTHHTH; lub HTHTTHTHHHT itp. Pewne sekwencje warstw T i H definiują rodzaj amorficznego węgla; ale w nich nie ma powtarzalnego trendu ani wzoru.
Z tego powodu strukturalnie trudno jest scharakteryzować te alotropy węgla; a zamiast tego preferowany jest procent węgla, który jest zmienną, która ułatwia jego różnice, oprócz właściwości fizycznych i skłonności do spalania lub spalania.
Grupy funkcjonalne
Wspomniano, że płaszczyzny heksagonalne mają niesparowany elektron, z którym może tworzyć wiązanie z innymi cząsteczkami lub atomami. Jeśli, powiedzmy, otaczające cząsteczki to H.dwaO i COdwa, Można oczekiwać, że utworzą się odpowiednio grupy OH i COOH. Mogą również wiązać się z atomami wodoru, tworząc wiązania C-H..
Możliwości są bardzo zróżnicowane, ale podsumowując, amorficzne węgle mogą zawierać utlenione grupy funkcyjne. Kiedy te heteroatomy są obecne, znajdują się nie tylko na krawędziach płaszczyzn, ale także, a nawet wewnątrz.
Grafit

Powyższy obrazek przedstawia model z kulkami i ciągami o strukturze krystalicznej grafitu. Na szczęście cienie sfer pomagają wizualizować chmury π w wyniku delokalizacji ich niesparowanych elektronów. Wspomniano o tym w pierwszej sekcji, bez tak wielu szczegółów.
Te chmury π można porównać do dwóch układów: pierścieni benzenowych i „mórz elektronowych” w metalicznych kryształach..
Orbitale p łączą się, aby zbudować tor, po którym elektrony przemieszczają się swobodnie; ale tylko między dwiema sześciokątnymi warstwami; prostopadle do nich nie ma przepływu elektronów ani prądu (elektrony musiałyby przejść przez atomy węgla).
Ponieważ istnieje ciągła migracja elektronów, nieustannie powstają chwilowe dipole, które indukują inne dipole atomów węgla, które znajdują się powyżej lub poniżej; to znaczy, warstwy lub arkusze grafitu pozostają razem dzięki siłom dyspersji londyńskiej..
Te heksagonalne warstwy, jak można się spodziewać, tworzą sześciokątny kryształ grafitu; a raczej szereg małych kryształów połączonych pod różnymi kątami. Chmury π zachowują się tak, jakby były „elektrycznym masłem”, pozwalając warstwom ślizgać się przed jakimikolwiek zewnętrznymi zakłóceniami na kryształach.
Właściwości fizyczne
Fizyczne właściwości grafitu są łatwe do zrozumienia po zbadaniu jego struktury molekularnej..
Przykładowo, temperatura topnienia grafitu jest bardzo wysoka (powyżej 4400ºC), ponieważ energia dostarczona w postaci ciepła musi nieodwracalnie rozdzielić warstwy heksagonalne, a także złamać ich sześciokąty..
Po prostu powiedziano, że ich warstwy mogą się ślizgać po sobie; I nie tylko, ale mogą również znaleźć się na innych powierzchniach, takich jak celuloza, z której składa się papier po osadzeniu się z grafitu ołówków. Ta właściwość pozwala grafitowi działać jako doskonały smar..
I, jak już wspomniano, jest dobrym przewodnikiem prądu elektrycznego, a także ciepła i dźwięku..
Grafeny

Chociaż nie było to pokazane na pierwszym zdjęciu, tego alotropu węgla nie można pominąć. Załóżmy, że warstwy grafitu zostały uchwycone i skondensowane w jeden arkusz, otwarty i pokrywający duży obszar. Gdyby było to zrobione molekularnie, powstałyby grafeny (górne zdjęcie).
Zatem grafeny to indywidualny arkusz grafitowy, który nie oddziałuje z innymi i może machać jak flaga. Zwróć uwagę, że przypomina on ściany plastra miodu pszczół.
Te arkusze grafenowe zachowują i zwielokrotniają właściwości grafitu. Jej sześciokąty są bardzo trudne do rozdzielenia, przez co mają fatalną odporność mechaniczną; nawet wyższy niż stal. Do tego są niezwykle lekkie i cienkie, a teoretycznie jeden ich gram wystarczyłby na pokrycie całego boiska piłkarskiego..
Jeśli spojrzysz ponownie na górny obraz, zobaczysz, że nie ma podwójnych wiązań. Z pewnością mogą być takie, a także potrójne wiązania (graffiny). Powiedzmy, że właśnie tutaj otwiera się chemia grafenu.
Podobnie jak grafit i inne warstwy heksagonalne, inne cząsteczki mogą wiązać się kowalencyjnie z powierzchnią grafenu, funkcjonalizując jego strukturę do zastosowań elektronicznych i biologicznych..
Nanorurki węglowe
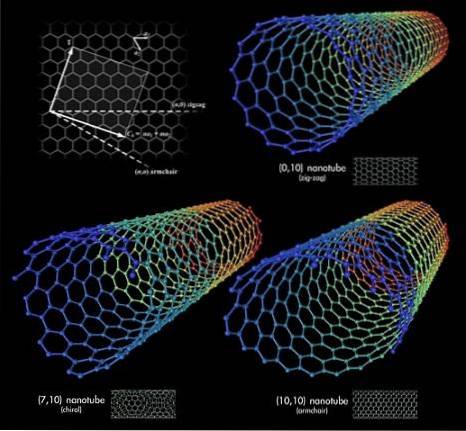
Teraz przypuśćmy, że złapaliśmy arkusze grafenu i zaczęliśmy zwijać je w rurkę; To są nanorurki węglowe. Długości i promień tych rur są zmienne, podobnie jak ich konformacje przestrzenne. Wraz z grafenem i fulerenami nanorurki te tworzą triadę najbardziej zaskakujących alotropów węgla.
Konformacje strukturalne
Na górnym zdjęciu pokazano trzy nanorurki węglowe. Jaka jest różnica między nimi? Wszystkie trzy mają ściany ze wzorem sześciokątnym i wykazują te same właściwości powierzchni, które zostały już omówione. Odpowiedź leży więc we względnych orientacjach tych sześciokątów.
Pierwsza konformacja odpowiada typowi zygzaka (prawy górny róg). Jeśli przyjrzysz się uważnie, zobaczysz, że ma rzędy sześciokątów ustawione idealnie prostopadle do osi podłużnej rury..
W przeciwieństwie do konformacji typu fotel, lub krzesło (prawy dolny róg), sześciokąty są ułożone w rzędach w tym samym kierunku co podłużna oś rury. W pierwszej nanorurce sześciokąty biegną po powierzchni w sensie jej średnicy, aw drugiej nanorurce biegną po powierzchni od „końca do końca”.
I wreszcie chiralna nanorurka (lewy dolny róg). Porównaj spiralne schody w lewo lub w prawo. To samo dzieje się z tą nanorurką węglową: jej sześciokąty są ułożone w górę w lewo lub w prawo. Ponieważ istnieją dwie wersje przestrzenne, mówi się wówczas, że wykazuje chiralność.
Fulereny
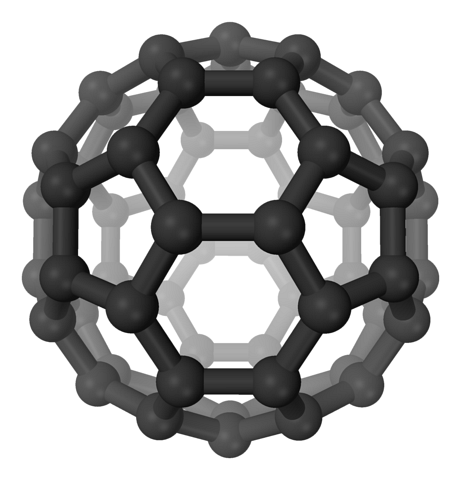
W fulerenach nadal zachowane są sześciokąty, ale dodatkowo pojawiają się pięciokąty, wszystkie z węglami spdwa. Arkusze lub warstwy są już pozostawione: teraz zostały złożone w taki sposób, że tworzą piłkę, podobnie jak piłka nożna; iw zależności od liczby węgli do piłki do rugby.
Fulereny to cząsteczki różniące się rozmiarem. Najbardziej znanym jest C60 (górne zdjęcie). Te alotropy węgla powinny być traktowane jak balony, które mogą ścisnąć się razem, tworząc kryształy, w których jony i inne cząsteczki mogą zostać uwięzione w ich szczelinach..
Te kulki są specjalnymi nośnikami lub podporami dla cząsteczek. W jaki sposób? Poprzez wiązania kowalencyjne do jego powierzchni, zwłaszcza do sąsiednich węgli sześciokąta. Następnie mówi się, że fulleren został sfunkcjonalizowany (addukt egzoedryczny).
Jego ściany można strategicznie rozbić, aby przechowywać cząsteczki w środku; przypominający sferyczną kapsułkę. Ponadto kulki te mogą mieć pęknięcia i być jednocześnie sfunkcjonalizowane; wszystko będzie zależało od aplikacji, do której są przeznaczone.
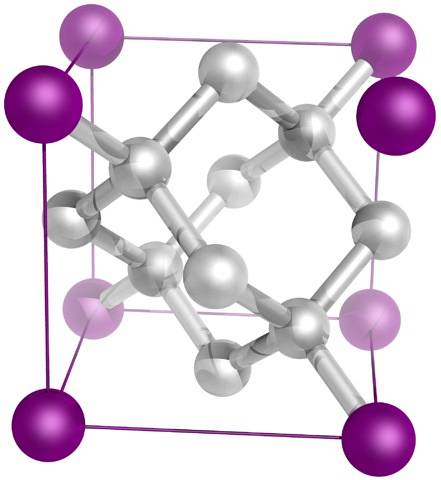
I wreszcie najbardziej znany ze wszystkich alotropów węgla: diament (chociaż nie wszystkie są węglem).
Strukturalnie składa się z atomów węgla sp3, tworząc cztery wiązania C-C i trójwymiarową sieć czworościanów (górny obraz), których krystaliczna komórka jest sześcienna. Jest to najtwardszy z minerałów, a jego temperatura topnienia jest bliska 4000ºC..
Jego czworościany są w stanie skutecznie przenosić ciepło w całej sieci krystalicznej; ale nie w przypadku elektryczności, ponieważ jej elektrony są bardzo dobrze rozmieszczone w czterech wiązaniach kowalencyjnych i nie mogą się nigdzie przenosić. Dlatego jest dobrym przewodnikiem ciepła, ale jest izolatorem elektrycznym..
W zależności od tego, jak jest fasetowany, może rozpraszać światło pod wieloma jasnymi i atrakcyjnymi kątami, dlatego są pożądane jako kamienie szlachetne i biżuteria..
Sieć jest bardzo odporna, ponieważ do poruszania jej czworościanów potrzebowałaby dużej presji. Ta właściwość sprawia, że jest to materiał o dużej wytrzymałości mechanicznej i twardości, zdolny do wykonywania precyzyjnych i czystych cięć, jak w przypadku skalpela z diamentową końcówką..
Ich kolory zależą od ich defektów krystalograficznych i zanieczyszczeń.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Méndez Medrano, Ma. Guadalupe, Rosu, H. C., Torres González, L. A. (2012). Grafen: najbardziej obiecujący alotrop węgla. Ustawa o uniwersytecie. vol. 22, nie. 3, kwiecień-maj 2012, s. 20-23, University of Guanajuato, Guanajuato, Meksyk.
- IES La Magdalena. Aviles. Asturias. (s.f.). Alotropowe formy węgla. [PDF]. Odzyskany z: fisquiweb.es
- Wikipedia. (2019). Alotropy węgla. Odzyskane z: es.wikipedia.org
- Sederberg David. (s.f.). Alotropy węgla. Odzyskany z: web.ics.purdue.edu
- Sederberg, D. (2009). Alotropy węgla: wszystko zależy od sposobu, w jaki jesteś złożony. Odzyskane z: physics.purdue.edu
- Hirsh A. (2010). Era alotropów węgla. Wydział Chemii i Farmacji oraz Interdyscyplinarne Centrum Materiałów Molekularnych (ICMM), Friedrich-Alexander University Erlangen-Norymberga, Henkestrasse 42, 91054 Erlangen, Niemcy.
- Rada Regentów Uniwersytetu Wisconsin System. (2013). Nanorurki i inne formy węgla. Odzyskany z: chemistry.beloit.edu
- Clark Jim. (2012). Gigantyczne struktury kowalencyjne. Źródło: chemguide.co.uk



Jeszcze bez komentarzy