
Jaka jest zewnętrzna konfiguracja elektronów?

Plik elektroniczna Konfiguracja, Nazywana również strukturą elektronową, jest to rozmieszczenie elektronów na poziomach energii wokół jądra atomowego. Zgodnie ze starym modelem atomowym Bohra elektrony zajmują różne poziomy na orbitach wokół jądra, od pierwszej powłoki najbliżej jądra, K, do siódmej powłoki Q, która jest najbardziej oddalona od jądra..
Jeśli chodzi o bardziej wyrafinowany model mechaniki kwantowej, powłoki K-Q są podzielone na zestaw orbitali, z których każdy może być zajęty przez nie więcej niż jedną parę elektronów..
Zwykle konfiguracja elektronów jest używana do opisania orbitali atomu w jego stanie podstawowym, ale może być również używana do reprezentowania atomu, który zjonizował się do kationu lub anionu, kompensując utratę lub zysk elektronów w ich odpowiednich orbitali ..
Wiele właściwości fizycznych i chemicznych pierwiastków można skorelować z ich unikalnymi konfiguracjami elektronicznymi. Elektrony walencyjne, elektrony w najbardziej zewnętrznej powłoce, są decydującym czynnikiem dla wyjątkowej chemii pierwiastka..
Podstawy konfiguracji elektronów
Przed przypisaniem elektronów atomu do orbitali należy zapoznać się z podstawami konfiguracji elektronów. Każdy pierwiastek w układzie okresowym składa się z atomów, które składają się z protonów, neutronów i elektronów..
Elektrony mają ładunek ujemny i znajdują się wokół jądra atomu na orbitali elektronu, definiowanej jako objętość przestrzeni, w której elektron można znaleźć z 95% prawdopodobieństwem..
Cztery różne typy orbitali (s, p, d i f) mają różne kształty, a jeden orbital może pomieścić maksymalnie dwa elektrony. Orbitale p, d i f mają różne podpoziomy, więc mogą pomieścić więcej elektronów.
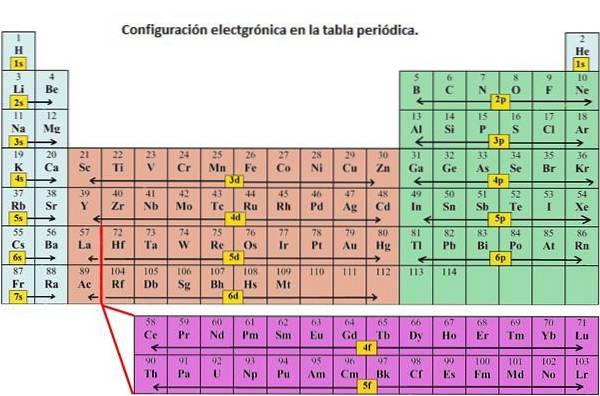
Jak wskazano, konfiguracja elektronów każdego pierwiastka jest unikalna dla jego pozycji w układzie okresowym. Poziom energii zależy od okresu, a liczbę elektronów określa liczba atomowa pierwiastka.
Orbitale na różnych poziomach energii są do siebie podobne, ale zajmują różne obszary w przestrzeni..
Orbital 1s i orbital 2s mają cechy orbitalu s (węzły promieniowe, prawdopodobieństwa objętości sferycznej, mogą zawierać tylko dwa elektrony itp.). Ale ponieważ znajdują się na różnych poziomach energii, zajmują różne przestrzenie wokół jądra. Każdy orbital może być reprezentowany przez określone bloki w układzie okresowym..
Blok s to obszar metali alkalicznych, w tym helu (grupy 1 i 2), blok d to metale przejściowe (grupy 3 do 12), blok p to elementy głównej grupy grup 13 do 18, a blok f to serie lantanowców i aktynowców.

Zasada Aufbau
Aufbau pochodzi od niemieckiego słowa „Aufbauen”, które oznacza „budować”. W istocie, pisząc konfiguracje elektronów, budujemy orbitale elektronów, gdy przechodzimy od jednego atomu do drugiego..
Kiedy piszemy konfigurację elektronową atomu, wypełnimy orbitale w kolejności rosnącej liczby atomowej.
Zasada Aufbau wywodzi się z zasady wykluczenia Pauliego, która mówi, że w atomie nie ma dwóch fermionów (np. Elektronów). Mogą mieć ten sam zestaw liczb kwantowych, więc muszą układać się w stosy przy wyższych poziomach energii.
Sposób gromadzenia się elektronów jest tematem konfiguracji elektronów (Zasada Aufbau, 2015).
Stabilne atomy mają tyle samo elektronów, ile protonów w jądrze. Elektrony gromadzą się wokół jądra w orbitali kwantowych zgodnie z czterema podstawowymi regułami zwanymi zasadą Aufbau..
- W atomie nie ma dwóch elektronów, które mają te same cztery liczby kwantowe n, l, m i s.
- Elektrony zajmą najpierw orbitale o najniższym poziomie energii.
- Elektrony zawsze będą wypełniać orbitale o tej samej liczbie spinowej. Kiedy orbitale będą pełne, zacznie się.
- Elektrony wypełnią orbitale sumą liczb kwantowych n i l. Orbitale o równych wartościach (n + l) zostaną najpierw wypełnione niższymi n wartościami.
Druga i czwarta zasada są w zasadzie takie same. Przykładem reguły czwartej byłyby orbitale 2p i 3s.
Orbital 2p to n = 2 i l = 2, a orbital 3s to n = 3 i l = 1. (N + l) = 4 w obu przypadkach, ale orbital 2p ma najniższą energię lub najniższą wartość n i będzie wypełnić przed warstwą 3s.
Na szczęście diagram Moellera pokazany na rysunku 2 może być użyty do wypełnienia elektronów. Wykres odczytuje się, wykonując przekątne od 1s.
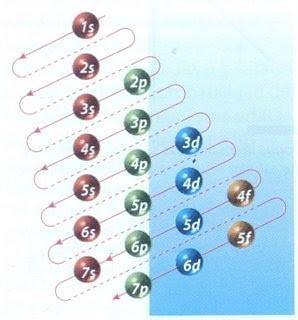
Rysunek 2 przedstawia orbitale atomowe, a strzałki wskazują drogę naprzód.
Teraz, gdy wiadomo, że kolejność orbitali jest wypełniona, jedyne, co pozostało, to zapamiętanie rozmiaru każdego orbitalu.
Orbitale S mają 1 możliwą wartość ml do przechowywania 2 elektronów
Orbitale P mają 3 możliwe wartości ml pomieścić 6 elektronów
Orbitale D mają 5 możliwych wartości ml pomieścić 10 elektronów
Orbitale F mają 7 możliwych wartości ml do przechowywania 14 elektronów
To wszystko, co jest potrzebne do określenia konfiguracji elektronicznej stabilnego atomu pierwiastka..
Na przykład weźmy pierwiastek azotu. Azot ma siedem protonów, a zatem siedem elektronów. Pierwszy orbital do wypełnienia to orbital 1s.
Orbital s ma dwa elektrony, więc zostało pięć elektronów. Następny orbital to orbital 2s i zawiera kolejne dwa. Ostatnie trzy elektrony trafią na orbital 2p, który może pomieścić do sześciu elektronów (Helmenstine, 2017).
Znaczenie zewnętrznej konfiguracji elektronów
Konfiguracje elektronów odgrywają ważną rolę w określaniu właściwości atomów.
Wszystkie atomy z tej samej grupy mają tę samą zewnętrzną konfigurację elektronową z wyjątkiem liczby atomowej n, dlatego mają podobne właściwości chemiczne.
Niektóre z kluczowych czynników wpływających na właściwości atomów obejmują rozmiar największych zajętych orbitali, energię orbitali o wyższej energii, liczbę pustych orbit oraz liczbę elektronów na orbitali o wyższej energii..
Większość właściwości atomowych można powiązać ze stopniem przyciągania najbardziej zewnętrznych elektronów do jądra i liczbą elektronów w najbardziej zewnętrznej powłoce elektronowej, liczbą elektronów walencyjnych.
Elektrony zewnętrznej powłoki to te, które mogą tworzyć kowalencyjne wiązania chemiczne, to one mają zdolność jonizacji do tworzenia kationów lub anionów i to one nadają stopień utlenienia pierwiastkom chemicznym.
Określą także promień atomowy. Gdy n rośnie, wzrasta promień atomowy. Kiedy atom straci elektron, nastąpi skurcz promienia atomu z powodu spadku ładunku ujemnego wokół jądra..
Elektrony powłoki zewnętrznej to te, które są brane pod uwagę przez teorię wiązań walencyjnych, teorię pola krystalicznego i teorię orbitali molekularnych w celu uzyskania właściwości cząsteczek i hybrydyzacji wiązań..
Bibliografia
- Zasada Aufbau. (2015, 3 czerwca). Pobrane z chem.libretexts: chem.libretexts.org.
- Bozeman Science. (2013, wyczerpany 4). Konfiguracja elektronów. Zaczerpnięte z youtube: youtube.com.
- Konfiguracje elektronowe i właściwości atomów. (S.F.). Zaczerpnięte z oneonta.edu: oneonta.edu.
- Encyclopædia Britannica. (2011, 7 września). Elektroniczna Konfiguracja. Zaczerpnięte z britannica: britannica.com.
- Faizi, S. (12 lipca 2016). Konfiguracje elektroniczne. Zaczerpnięte z chem.libretexts: chem.libretexts.org.
- Helmenstine, T. (7 marca 2017). Zasada Aufbau - struktura elektroniczna i zasada Aufbau. Zaczerpnięte z thinkco: thinkco.com.
- Khan, S. (8 czerwca 2014). Elektrony walencyjne i wiązania. Zaczerpnięte z khanacademy: khanacademy.org.


Jeszcze bez komentarzy