
Historia, budowa, właściwości, zastosowania arsenu
Plik arsen Jest to półmetal lub metaloid należący do grupy 15 lub VA układu okresowego. Jest reprezentowany przez symbol chemiczny As, a jego liczba atomowa wynosi 33. Występuje w trzech formach alotropowych: żółtej, czarnej i szarej; ta ostatnia jako jedyna ma znaczenie przemysłowe.
Szary arsen to kruche, metalicznie wyglądające ciało stałe o stalowym, krystalicznym kolorze (zdjęcie poniżej). Traci swój połysk pod wpływem powietrza, tworząc tlenek arsenu (AsdwaLUB3), który po podgrzaniu wydziela zapach czosnku. Z drugiej strony, jego żółte i czarne alotropy są odpowiednio molekularne i bezpostaciowe..

Arsen znajduje się w skorupie ziemskiej związanej z licznymi minerałami. Tylko niewielka część występuje w stanie rodzimym, jednak związana jest z antymonem i srebrem.
Do najczęstszych minerałów, w których znajduje się arsen, należą: realgar (As4S4), orpiment (AsdwaS3), loellingit (FeAsdwa) i enargit (Cu3Tyłek4). Arsen jest również uzyskiwany jako produkt uboczny wytopu metali, takich jak ołów, miedź, kobalt i złoto..
Związki arsenu są toksyczne, zwłaszcza arsyn (AsH3). Jednak arsen ma wiele zastosowań przemysłowych, w tym stapianie z ołowiem, stosowane do produkcji akumulatorów samochodowych oraz stapianie z galem o różnych zastosowaniach w elektronice..
Indeks artykułów
- 1 Historia jego odkrycia
- 2 Struktura arsenu
- 2.1 Żółty arsen
- 2.2 Czarny arszenik
- 3 Konfiguracja elektroniczna
- 4 Właściwości
- 4.1 Masa cząsteczkowa
- 4.2 Opis fizyczny
- 4.3 Kolor
- 4.4 Zapach
- 4.5 Smak
- 4.6 Temperatura topnienia
- 4.7 Gęstość
- 4.8 Rozpuszczalność w wodzie
- 4.9 Promień atomowy
- 4.10 Objętość atomowa
- 4.11 Promień kowalencyjny
- 4.12 Ciepło właściwe
- 4.13 Ciepło parowania
- 4.14 Elektroujemność
- 4.15 Energia jonizacji
- 4.16 stopnie utlenienia
- 4.17 Stabilność
- 4.18 Rozkład
- 4.19 Samozapłon
- 4.20 Twardość
- 4.21 Reaktywność
- 5 zastosowań
- 5.1 Stopy
- 5.2 Elektronika
- 5.3 Rolnictwo i ochrona drewna
- 5.4 Leczniczy
- 5.5 Inne zastosowania
- 6 Gdzie jest?
- 7 Jak otrzymujesz?
- 8 Odniesienia
Historia jego odkrycia
Nazwa `` arsen '' pochodzi od łacińskiego arsenicum i greckiego arsenikon, odnosząc się do żółtego orpimentu, który był główną formą stosowania arsenu przez alchemików.
Arsen na długo przed uznaniem go za pierwiastek chemiczny był znany i stosowany w postaci jego związków. Na przykład Arystoteles w IV wieku pne. napisał o sandarache, substancji uważanej obecnie za siarczek arsenu.
Pliniusz Starszy i Pedanius Discórides w I wieku naszej ery opisali orpiment, minerał składający się z AsdwaS3. W XI wieku rozpoznano trzy gatunki arsenu: biały (As4LUB4), żółty (AsdwaS3) i czerwony (As4S4).
Arsen jako czysty pierwiastek po raz pierwszy zaobserwował Albertus Magnus (1250). Magnus podgrzał siarczek arsenu mydłem, zauważając pojawienie się substancji o charakterystyce podobnej do szarawego alotropu na obrazie. Jednak pierwszy autentyczny raport o jego izolacji został opublikowany w 1649 roku przez niemieckiego aptekarza Johanna Schroedera..
Schroeder przygotował arsen, ogrzewając jego tlenek węglem drzewnym. Następnie Nicolas Lémery zdołał go wyprodukować, ogrzewając mieszaninę tlenku arsenu, mydła i potażu. W XVIII wieku ostatecznie uznano ten element za półmetaliczny.
Struktura arsenu
Arsen jest izomorficzny do antymonu; to znaczy są one strukturalnie identyczne, różniąc się jedynie wielkością atomów. Każdy atom arsenu tworzy trzy wiązania kowalencyjne As-As, w taki sposób, że tworzą one heksagonalne jednostki As6 „Pomarszczony lub stromy”, ponieważ hybrydyzacja atomów As jest sp3.
Następnie jednostki As6 łączą się, tworząc czyste warstwy arsenu, które słabo oddziałują ze sobą. Dzięki siłom międzycząsteczkowym, zależnym przede wszystkim od ich mas atomowych, romboedryczne szare kryształy arsenu nadają ciału stałą kruchą i kruchą teksturę..
Prawdopodobnie z powodu odpychania wolnej pary elektronów arsenu, As6 utworzone między równoległymi warstwami nie definiują idealnego, ale zniekształconego ośmiościanu:
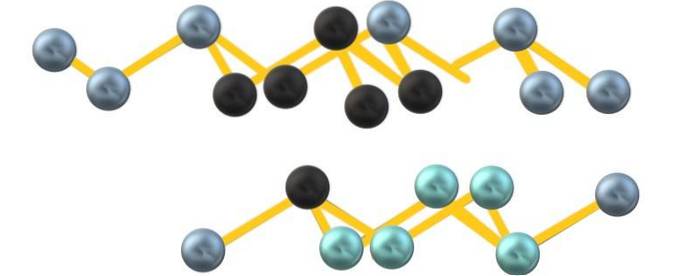
Zwróć uwagę, że czarne kule rysują zniekształconą płaszczyznę w przestrzeni między dwiema stromymi warstwami. Podobnie w warstwie poniżej znajdują się niebieskawe kule, które wraz z czarną kulą tworzą jednostkę As6 wymienione na początku rozdziału.
Struktura wygląda na uporządkowaną, rzędy wznoszą się i opadają, dzięki czemu jest krystaliczna. Jednak może stać się bezpostaciowy, z kulkami ściśniętymi na różne sposoby. Kiedy szarawy arsen staje się amorficzny, przekształca się w półprzewodnik.
Arsen żółty
Arsen żółty, najbardziej toksyczny alotrop tego pierwiastka, jest czysto molekularną substancją stałą. Składa się z cząsteczek As4 jednostki przez słabe siły rozpraszające, które nie zapobiegają ich ulatnianiu się.
Arszenik czarny
Czarny arsen jest amorficzny; ale nie tak, jak może być szarawy alotrop. Jego struktura jest nieco podobna do opisanej powyżej, z tą różnicą, że są to płaszczyzny jednostek As6 mają większe obszary i różne wzory bałaganu.
Elektroniczna Konfiguracja
[Ar] 3d104sdwa4p3
Ma wypełnione wszystkie orbitale poziomu 3. Tworzy wiązania za pomocą orbitali 4s i 4p (podobnie jak 4d) poprzez różne hybrydyzacje chemiczne.
Nieruchomości
Waga molekularna
74,922 g / mol
Opis fizyczny
Szary arsen jest szarawym ciałem stałym o metalicznym wyglądzie i kruchej konsystencji..
Kolor
Trzy formy alotropowe, żółta (alfa), czarna (beta) i szara (gamma).
Zapach
Toaleta
Smak
Bez smaku
Temperatura topnienia
1090 K przy 35,8 atm (potrójny punkt arsenu).
Pod normalnym ciśnieniem nie ma temperatury topnienia, ponieważ sublimuje do 887 K..
Gęstość
-Arsen szary: 5,73 g / cm3.
-Arsen żółty: 1,97 g / cm3.
Rozpuszczalność w wodzie
Nierozpuszczalny
Radio atomowe
139 pm
Objętość atomowa
13,1 cm3/ mol
Promień kowalencyjny
120 po południu
Ciepło właściwe
0,328 J / gmol w 20 ° C
Ciepło parowania
32,4 kJ / mol
Elektroujemność
2.18 w skali Paulinga
Energia jonizacji
Pierwsza energia jonizacji 946,2 kJ / mol
Stany utleniania
-3, +3, +5
Stabilność
Arsen elementarny jest stabilny w suchym powietrzu, ale wystawiony na działanie wilgotnego powietrza zostaje pokryty brązowożółtą warstwą, która może stać się czarną warstwą tlenku arsenu (AsdwaLUB3).
Rozkład
Gdy arsen jest podgrzewany do rozkładu, wydziela biały dym AsdwaLUB3. Procedura jest niebezpieczna, ponieważ może również uwolnić arsyn, bardzo trujący gaz.
Samozapłon
180 ºC
Twardość
3,5 w skali twardości Mohsa.
Reaktywność
Nie jest atakowany przez zimny kwas siarkowy ani stężony kwas solny. Reaguje z gorącym kwasem azotowym lub siarkowym, tworząc kwas arsenowy i kwas arsenowy.
Kiedy szary arsen ulatnia się przez ogrzewanie, a jego opary są szybko schładzane, tworzy się żółty arsen. Po wystawieniu na działanie światła ultrafioletowego powraca do szarej formy.
Aplikacje
Stopy
Niewielka ilość arsenu dodana do ołowiu utwardza jego stopy na tyle, że można je wykorzystać do powlekania kabli oraz do produkcji akumulatorów samochodowych..
Dodatek arsenu do mosiądzu, stopu miedzi i cynku, zwiększa jego odporność na korozję. Z drugiej strony koryguje lub zmniejsza utratę cynku w mosiądzu, co powoduje wydłużenie jego żywotności..
elektronika
Oczyszczony arsen jest stosowany w technologii półprzewodników, gdzie jest używany w połączeniu z galem i germanem, a także w postaci arsenku galu (GaAs), który jest drugim najpowszechniej stosowanym półprzewodnikiem.
GaAs mają bezpośrednią przerwę wzbronioną, która może być stosowana w produkcji diod, laserów i diod LED. Oprócz arsenku galu istnieją inne arsenki, takie jak arsenek indu i arsenek glinu, które są również półprzewodnikami III-V..
Tymczasem arsenek kadmu jest półprzewodnikiem typu II-IV. Arsine był używany w domieszkowaniu półprzewodników.
Rolnictwo i ochrona drewna
Większość zastosowań została odrzucona ze względu na ich wysoką toksyczność i ich związki. AsdwaLUB3 został użyty jako pestycyd, podczas gdy AsdwaLUB5 jest składnikiem herbicydów i insektycydów.
Kwas arsenowy (H.3AsO4) oraz sole, takie jak arsenian wapnia i arsenian ołowiu, były używane do sterylizacji gleby i zwalczania szkodników. Stwarza to ryzyko skażenia środowiska arszenikiem..
Arsenian ołowiu był stosowany jako środek owadobójczy na drzewach owocowych do pierwszej połowy XX wieku. Jednak ze względu na swoją toksyczność zastąpiono go metylenianem sodu, który przestał być stosowany z tego samego powodu od 2013 roku.
Leczniczy
Do XX wieku kilka jego związków było stosowanych jako leki. Na przykład arfenamina i neolsalvarsan są stosowane w leczeniu kiły i trypanosomatozy.
W 2000 roku użycie AsdwaLUB3, Bardzo toksyczny związek w leczeniu ostrej białaczki promielocytowej opornej na kwas all-trans-retinowy. Ostatnio zastosowano izotop promieniotwórczy 74As w lokalizacji guza.
Izotop daje dobre obrazy, wyraźniejsze niż te otrzymane za pomocą 124Ja, ponieważ jod jest przenoszony do tarczycy i generuje szum w sygnale.
Inne zastosowania
Arsen był używany w przeszłości jako dodatek paszowy w produkcji drobiu i trzody chlewnej.
Jest używany jako katalizator w produkcji tlenku etylenu. Jest również używany w fajerwerkach i garbarstwie. Tlenek arsenu jest używany jako odbarwiacz w produkcji szkła.
Gdzie to się znajduje?
Arsen można znaleźć w niewielkich ilościach w stanie elementarnym, o wysokim stopniu czystości. Występuje w wielu związkach, takich jak: siarczki, arsenki i sulfoarseniidy.
Występuje również w kilku minerałach, w tym: arsenopirycie (FeSA), loellingycie (FeAsdwa), enargit (Cu3Tyłek4), orpiment (AsdwaS3) i realgar (As4S4).
Jak to się uzyskuje?
Arsenopiryt jest podgrzewany do 650-700ºC bez dostępu powietrza. Arsen wyparowuje, pozostawiając siarczek żelaza (FeS) jako pozostałość. Podczas tego procesu arsen łączy się z tlenem, tworząc As4LUB6, znany jako „biały arszenik”.
As4LUB6 jest zmodyfikowany, aby utworzyć AsdwaLUB3, którego opary są zbierane i skraplane w zestawie ceglanych komór, przy czym arszenik jest oczyszczany metodą sublimacji.
Większość arsenu jest wytwarzana przez redukcję węglem pyłu utworzonego z AsdwaLUB3.
Bibliografia
- Stephen R. Marsden. (23 kwietnia 2019). Chemia arsenu. Chemia LibreTexts. Źródło: chem.libretexts.org
- Helmenstine, dr Anne Marie (3 grudnia 2018). Ciekawe fakty dotyczące arsenu. Odzyskany z: thinkco.com
- Wikipedia. (2019). Arsen. Odzyskane z: en.wikipedia.org
- Dr Dough Stewart. (2019). Fakty dotyczące pierwiastka arsenu. Chemicool. Źródło: chemicool.com
- Królewskie Towarzystwo Chemii. (2019). Arsen. Odzyskany z: rsc.or
- Redaktorzy Encyclopaedia Britannica. (03 maja 2019). Arsen. Encyclopædia Britannica. Odzyskany z: britannica.com



Jeszcze bez komentarzy