
Struktura, właściwości, zastosowania i zagrożenia cyklopropanu (C3H6)

Plik cyklopropan jest cykliczną cząsteczką o wzorze cząsteczkowym C.3H.6, i składa się z trzech atomów węgla połączonych ze sobą w postaci pierścienia. W chemii istnieje rodzina węglowodorów nasyconych, których szkielet składa się z atomów węgla połączonych pojedynczymi wiązaniami w postaci pierścienia..
Ta rodzina składa się z różnej liczby cząsteczek (różniących się długością głównego łańcucha węglowego) i wiadomo, że mają wyższą temperaturę topnienia i wrzenia niż te o wysokich łańcuchach, a także większą od nich reaktywność..
Cyklopropan został odkryty w 1881 roku przez austriackiego chemika Augusta Freunda, który był zdeterminowany, aby dowiedzieć się, co jest toksycznym pierwiastkiem w etylenie i który doszedł do wniosku, że jest to ten sam cyklopropan.
Mimo to dopiero w latach trzydziestych XX wieku zaczęto go produkować na poziomie przemysłowym, kiedy odkryto jego zastosowanie jako znieczulenie, ponieważ wcześniej nie uważali go za atrakcyjność handlową..
Indeks artykułów
- 1 Struktura chemiczna
- 2 Właściwości
- 2.1 Temperatura wrzenia
- 2.2 Temperatura topnienia
- 2.3 Gęstość
- 2.4 Reaktywność
- 3 Zastosowania
- 4 Ryzyka
- 5 Referencje
Struktura chemiczna
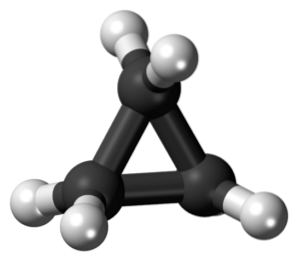
Cyklopropan o wzorze cząsteczkowym C.3H.6, Składa się z trzech małych atomów węgla, które łączą się w takiej konfiguracji, że tworzy się pierścień, pozostawiając molekularną symetrię D3h na każdym węglu w łańcuchu.
Struktura tej cząsteczki wymaga, aby kąty powstających wiązań wynosiły około 60º, znacznie mniej niż 109,5º, które obserwuje się między atomami hybrydy sp.3, co jest kątem bardziej stabilnym termodynamicznie.
Prowadzi to do tego, że pierścień cierpi na większe naprężenia strukturalne niż inne struktury tego typu, oprócz naturalnego naprężenia skrętnego, które posiada z powodu zaćmienia konformacji jego atomów wodoru..
Z tego samego powodu wiązania, które tworzą się między atomami węgla w tej cząsteczce są znacznie słabsze niż w zwykłych alkanach..
W szczególny sposób iw przeciwieństwie do innych wiązań, w których bliskość między dwiema cząsteczkami symbolizuje większą energię wiązania, wiązania między atomami węgla tej cząsteczki mają tę szczególną cechę, że mają krótszą długość niż inne alkany (ze względu na ich geometrię), a jednocześnie czas są słabsze niż związki między nimi.
Ponadto cyklopropan ma stabilność dzięki cyklicznej delokalizacji sześciu elektronów w wiązaniach węgiel-węgiel, jest nieco bardziej niestabilny niż cyklobutan i znacznie bardziej niż cykloheksan..
Nieruchomości
Temperatura wrzenia
W porównaniu z innymi, bardziej powszechnymi cykloalkanami, cyklopropan ma najniższą temperaturę wrzenia spośród tego typu cząsteczek, ulatniając się w temperaturze 33 stopni poniżej zera (żadne inne cykloalkany nie ulatniają się w temperaturach poniżej zera).
Z drugiej strony, w porównaniu do liniowego propanu, cyklopropan ma wyższą temperaturę wrzenia: ulatnia się w temperaturze 42 ° C poniżej zera, nieco niższą niż jego cykloalkanowy kuzyn.
Temperatura topnienia
Temperatura topnienia cyklopropanu jest niższa niż innych cykloalkanów, topniejąc w temperaturze 128 ° C niższej od zera. Mimo to nie jest to jedyny cykloalkan, który topi się w temperaturze poniżej zera, a zjawisko to można również zaobserwować w cyklobutanie, cyklopentanie i cykloheptanie..
Tak więc w przypadku liniowego propanu topi się on w temperaturze poniżej 187 ° C poniżej zera..
Gęstość
Cyklopropan ma największą gęstość wśród cykloalkanów, będąc ponad dwukrotnie wyższą niż najgęstszy zwykły cykloalkan (1,879 g / l dla cyklopropanu, przewyższający cyklodekan 0,871).
Wyższą gęstość obserwuje się również w cyklopropanie niż w liniowym propanie. Różnica temperatur wrzenia i topnienia między liniowymi alkanami i cykloalkanami wynika z wyższych sił Londynu, które są zwiększane przez kształt pierścienia, który pozwala na większą powierzchnię kontaktu między wewnętrznymi atomami..
Reaktywność
Na reaktywność cząsteczki cyklopropanu bezpośrednio wpływa słabość jej wiązań, znacznie zwiększająca się w porównaniu z innymi cykloalkanami z powodu wpływu napięcia wywieranego na te wiązania..
Dzięki temu cyklopropan można łatwiej oddzielić, aw niektórych reakcjach może zachowywać się jak alken. W rzeczywistości ekstremalna reaktywność mieszanin cyklopropanu i tlenu może stać się zagrożeniem wybuchowym..
Aplikacje
Komercyjne zastosowanie cyklopropanu par excellence jako środka znieczulającego, badanie tej właściwości po raz pierwszy w 1929 r..
Cyklopropan jest silnym, szybko działającym środkiem znieczulającym, który nie podrażnia dróg oddechowych ani nie ma nieprzyjemnego zapachu. Był używany przez kilka dziesięcioleci razem z tlenem w celu usypiania pacjentów podczas operacji, ale zaczęto obserwować niepożądane skutki uboczne, określane jako „wstrząs cyklopropanowy”..
Wraz z kosztami i wysoką palnością przeszedł proces wyrzucania i zastępowania innymi bezpieczniejszymi środkami znieczulającymi..
Chociaż nadal był częścią związków stosowanych do indukcji znieczulenia, dziś nie jest częścią środków stosowanych w zastosowaniach medycznych.
Ryzyka
- Cyklopropan to wysoce łatwopalny gaz, który w kontakcie z płomieniem wytwarza toksyczne gazy. Ponadto może reagować z czynnikami utleniającymi, takimi jak nadchlorany, nadtlenki, nadmanganiany, azotany i halogeny, powodując pożary i / lub wybuchy..
- Wysokie poziomy cyklopropanu mogą powodować bóle głowy, zawroty głowy, nudności, utratę koordynacji, uczucie omdlenia i / lub oszołomienie..
- Może również prowadzić do zaburzeń rytmu serca lub arytmii, trudności w oddychaniu, śpiączki, a nawet śmierci..
- Skroplony cyklopropan może powodować odmrożenia skóry ze względu na jego temperaturę znacznie poniżej zera.
- Ponieważ w warunkach otoczenia jest gazem, związek ten może łatwo dostać się do organizmu poprzez powietrze, a także obniża poziom tlenu w powietrzu..
Bibliografia
- Britannica, E. (s.f.). Cyklopropan. Pobrane z britannica.com
- Chemistry, O. (s.f.). Synteza cyklopropanu. Odzyskany z organic-chemistry.org
- ChemSpider. (s.f.). Cyklopropan. Pobrane z chemspider.com
- Wagnières, O. (s.f.). Produkty naturalne zawierające cyklopropan. Odzyskany z lspn.epfl.ch
- Wikipedia. (s.f.). Cyklopropan. Pobrane z en.wikipedia.org



Jeszcze bez komentarzy