
Wodory benzylu-benzylu, karbokationy, rodniki benzylowe
Plik benzyl lub benzyl jest wspólną grupą podstawnikową w chemii organicznej, której wzór to C6H.5CHdwa- lub Bn-. Strukturalnie składa się po prostu z połączenia grupy metylenowej, CHdwa, z grupą fenylową, C6H.5; to znaczy carbon sp3 bezpośrednio związany z pierścieniem benzenowym.
Dlatego grupę benzylową można postrzegać jako pierścień aromatyczny przyłączony do małego łańcucha. W niektórych tekstach preferowane jest użycie skrótu Bn zamiast C6H.5CHdwa-, być łatwo rozpoznawalnym w każdym związku; zwłaszcza gdy jest przyłączony do atomu tlenu lub azotu, O-Bn lub NBndwa, odpowiednio.

Ta grupa występuje również pośrednio w wielu szeroko znanych związkach. Na przykład do kwasu benzoesowego C6H.5COOH, można uznać za benzyl, którego węgiel sp3 przeszedł intensywne utlenianie; lub benzaldehyd, C.6H.5CHO z częściowego utleniania; i alkohol benzylowy, C.6H.5CHdwaOH, jeszcze mniej zardzewiały.
Inny nieco oczywisty przykład tej grupy można znaleźć w toluenie C6H.5CH3, które mogą podlegać pewnej liczbie reakcji w wyniku niezwykłej stabilności wynikającej z rodników benzylowych lub karbokationów. Jednak grupa benzylowa służy do ochrony grup OH lub NH.dwa reakcji, które w niepożądany sposób modyfikują syntetyzowany produkt.
Indeks artykułów
- 1 Przykłady związków z grupą benzylową
- 2 Wodory benzylu
- 3 Karbokany i rodniki benzylowe
- 3.1 Rezonans w grupie benzylowej
- 3.2 Inne rodniki
- 4 reakcje
- 5 Referencje
Przykłady związków z grupą benzylową
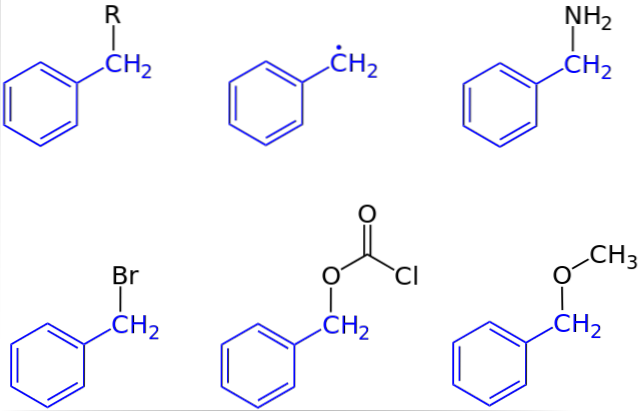
Na pierwszym zdjęciu przedstawiono ogólny wygląd związku z grupą benzylową: C6H.5CHdwa-R, gdzie R może oznaczać dowolny inny fragment lub atom cząsteczki. Zatem zmieniając R można otrzymać dużą liczbę przykładów; niektóre proste, inne tylko dla określonego regionu większej struktury lub zestawu.
Na przykład alkohol benzylowy pochodzi z podstawienia OH zamiast R: C6H.5CHdwa-O. Jeśli zamiast OH jest to grupa NHdwa, następnie powstaje związek benzyloaminy: C6H.5CHdwa-NHdwa.
Jeśli Br jest atomem zastępującym R, uzyskanym związkiem jest bromek benzylu: C6H.5CHdwa-Br; R jak COdwaCl daje ester, chlorowęglan benzylu (lub chlorek karbobenzoksylu); i OCH3 daje eter benzylometylowy, C6H.5CHdwa-OCH3.
Nawet (choć nie całkiem poprawnie), R można założyć przez samotny elektron: rodnik benzylowy, C6H.5CHdwa·, Produkt wyzwolenia radykalnego R. ·. Innym przykładem, choć nieuwzględnionym na zdjęciu, jest fenyloacetonitryl lub cyjanek benzylu, C.6H.5CHdwa-CN.
Istnieją związki, w których grupa benzylowa prawie nie reprezentuje określonego regionu. W takim przypadku skrót Bn jest często używany w celu uproszczenia konstrukcji i jej ilustracji..
Wodory benzylu
Powyższe związki mają wspólny nie tylko pierścień aromatyczny lub fenylowy, ale także atomy wodoru benzylowego; to są te, które należą do węgla sp3.
Takie wodory można przedstawić jako: Bn-CH3, Bn-CHdwaR lub Bn-CHRdwa. Związek Bn-CR3 nie zawiera wodoru benzylowego, a zatem jego reaktywność jest mniejsza niż pozostałych.
Te wodory różnią się od tych, które są zwykle przyłączone do węgla sp3.
Na przykład rozważmy metan, CH4, który można również zapisać jako CH3-H. Do zerwania wiązania CH3-H w rozkładzie heterolitycznym (tworzenie rodników), należy dostarczyć pewną ilość energii (104kJ / mol).
Jednak energia dla tego samego wiązania C pęka6H.5CHdwa-H jest niższy w porównaniu do metanu (85 kJ / mol). Ponieważ ta energia jest mniejsza, oznacza to, że rodnik C6H.5CHdwaJest bardziej stabilny niż CH3·. To samo dzieje się w mniejszym lub większym stopniu z innymi wodorami benzylowymi.
W konsekwencji wodory benzylowe są bardziej reaktywne w tworzeniu bardziej stabilnych rodników lub karbokationów niż te powodowane przez inne wodory. Dlaczego? Odpowiedź na pytanie znajduje się w następnej sekcji.
Karbokationy i rodniki benzylowe
Radykalny C był już rozważany6H.5CHdwa·, Brak karbokationu benzylu: C6H.5CHdwa+. W pierwszym występuje pojedynczy niesparowany elektron, aw drugim niedobór elektroniki. Te dwa rodzaje są bardzo reaktywne i reprezentują związki przejściowe, z których powstają końcowe produkty reakcji..
Carbon sp3, po utracie jednego lub dwóch elektronów w celu utworzenia rodnika lub karbokationu, odpowiednio, może przyjąć hybrydyzację spdwa (płaszczyzna trygonalna), w taki sposób, aby było jak najmniejsze odpychanie między jego grupami elektronowymi. Ale jeśli zdarzy się, że jest to spdwa, Podobnie jak węgle w pierścieniach aromatycznych, czy może wystąpić koniugacja? Odpowiedź brzmi tak.
Rezonans w grupie benzylowej
Ta koniugacja lub rezonans jest kluczowym czynnikiem wyjaśniającym stabilność tych pochodnych benzylu lub benzylu. Poniższy obraz ilustruje takie zjawisko:
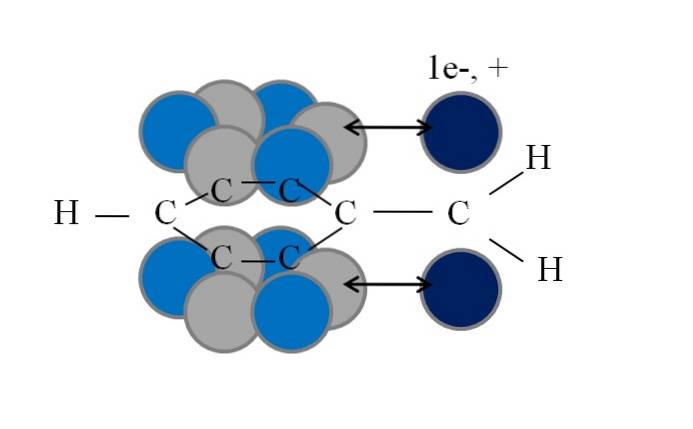
Zauważ, że tam, gdzie znajdował się jeden z benzylowych wodorów, pozostała orbital p z niesparowanym elektronem (rodnik, 1e-) lub nieważne (karbokacja, +). Jak widać, ten orbital p jest równoległa do układu aromatycznego (szare i jasnoniebieskie kółka), z podwójną strzałką wskazującą początek koniugacji.
Zatem zarówno niesparowany elektron, jak i ładunek dodatni mogą być przenoszone lub rozpraszane przez pierścień aromatyczny, ponieważ równoległość ich orbitali sprzyja temu geometrycznie. Jednak te nie leżą na żadnym orbicie p pierścień aromatyczny; tylko w węglach w pozycjach orto i para w odniesieniu do CHdwa.
Dlatego jasnoniebieskie koła wyróżniają się nad szarymi: w nich skoncentrowana jest odpowiednio ujemna lub dodatnia gęstość rodnika lub karbokationu..
Inni radykałowie
Należy wspomnieć, że ta koniugacja lub rezonans nie może wystąpić w węglach sp3 najbardziej odległy od pierścienia aromatycznego.
Na przykład rodnik C6H.5CHdwaCHdwaJest znacznie bardziej niestabilny, ponieważ niesparowany elektron nie może sprzęgać się z pierścieniem, gdy interweniuje grupa CHdwa pomiędzy iz hybrydyzacją sp3. To samo dotyczy C.6H.5CHdwaCHdwa+.
Reakcje
Podsumowując: wodory benzylowe są podatne na reakcje, generując rodnik lub karbokation, co z kolei powoduje powstanie końcowego produktu reakcji. Dlatego reagują poprzez mechanizm SN.1.
Przykładem jest bromowanie toluenu pod wpływem promieniowania ultrafioletowego:
do6H.5CH3 + 1 / 2Brdwa => C.6H.5CHdwaBr
do6H.5CHdwaBr + 1 / 2Brdwa => C.6H.5CHBrdwa
do6H.5CHBrdwa + 1 / 2Brdwa => C.6H.5CBr3
W rzeczywistości w tej reakcji powstają rodniki Br..
Z drugiej strony sama grupa benzylowa reaguje w celu ochrony grup OH lub NH.dwa w prostej reakcji podstawienia. Zatem alkohol ROH można „benzylować” przy użyciu bromku benzylu i innych odczynników (KOH lub NaH):
ROH + BnBr => ROBn + HBr
ROBn to eter benzylowy, do którego można zawrócić jego początkową grupę OH, jeśli zostanie poddany działaniu ośrodka redukcyjnego. Ten eter powinien pozostać niezmieniony, podczas gdy inne reakcje są przeprowadzane na związku..
Bibliografia
- Morrison, R.T. i Boyd, R. N. (1987). Chemia organiczna. (Wydanie 5). Addison-Wesley Iberoamericana.
- Carey, F. A. (2008). Chemia organiczna. (6. wydanie). McGraw-Hill, Interamerica, Editores S.A.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. Aminy. (Wydanie 10.). Wiley plus.
- Wikipedia. (2019). Grupa benzylowa. Odzyskane z: en.wikipedia.org
- Dr Donald L. Robertson. (5 grudnia 2010). Fenyl czy benzyl? Odzyskany z: home.miracosta.edu
- Gamini Gunawardena. (12 października 2015). Benzylic Carbocation. Chemia LibreTexts. Źródło: chem.libretexts.org



Jeszcze bez komentarzy