
Struktura, właściwości, zagrożenia i zastosowania wodorowęglanu wapnia
Plik wodorowęglan wapnia jest solą nieorganiczną o wzorze chemicznym Ca (HCO3)dwa. Pochodzi w naturze z węglanu wapnia obecnego w kamieniach wapiennych i minerałach, takich jak kalcyt.
Wodorowęglan wapnia jest lepiej rozpuszczalny w wodzie niż węglan wapnia. Ta cecha pozwoliła na tworzenie systemów krasowych w skałach wapiennych oraz w strukturze jaskiń..

Woda gruntowa, która przechodzi przez szczeliny, zostaje nasycona w wyniku wypierania dwutlenku węgla (COdwa). Wody te powodują erozję skał wapiennych, uwalniając węglan wapnia (CaCO3), który utworzy wodorowęglan wapnia, zgodnie z następującą reakcją:
Złodziej3(s) + COdwa(g) + HdwaO (l) => Ca (HCO3)dwa(aq)
Ta reakcja zachodzi w jaskiniach, w których powstają bardzo twarde wody. Wodorowęglan wapnia nie jest w stanie stałym, ale w roztworze wodnym razem z Cadwa+, wodorowęglan (HCO3-) i jon węglanowy (CO3dwa-).
Następnie poprzez zmniejszenie nasycenia wody dwutlenkiem węgla następuje reakcja odwrotna, czyli przemiana wodorowęglanu wapnia w węglan wapnia:
Ca (HCO3)dwa(aq) => COdwa (g) + HdwaO (l) + CaCO3 (s)
Węglan wapnia jest słabo rozpuszczalny w wodzie, co powoduje, że jego wytrącanie występuje w postaci ciała stałego. Powyższa reakcja jest bardzo ważna w tworzeniu się w jaskiniach stalaktytów, stalagmitów i innych nacieków naciekowych..
Te skaliste struktury powstają z kropli wody spadających z sufitu jaskiń (górne zdjęcie). CaCO3 obecny w kropelkach wody krystalizuje, tworząc wyżej wymienione struktury.
Fakt, że wodorowęglan wapnia nie występuje w stanie stałym, utrudnił jego użycie, a znaleziono kilka przykładów. Podobnie trudno jest znaleźć informacje na temat jego toksycznych skutków. Istnieje doniesienie o szeregu skutków ubocznych jego stosowania jako leku zapobiegającego osteoporozie.
Struktura
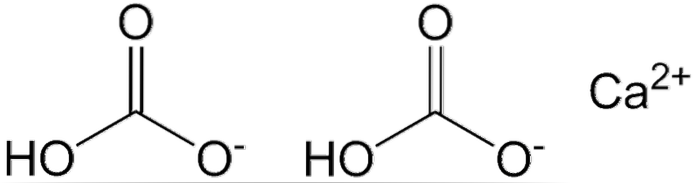
Na powyższym obrazku pokazano dwa aniony HCO3- i kation Cadwa+ oddziałujące elektrostatycznie. Okołodwa+ zgodnie z obrazkiem powinien znajdować się pośrodku, ponieważ w ten sposób HCO3- nie odpychałyby się nawzajem z powodu swoich ujemnych ładunków.
Ujemny ładunek na HCO3- delokalizuje między dwoma atomami tlenu, poprzez rezonans między grupą karbonylową C = O i wiązaniem C-O-; będąc w CO3dwa-, jest zdelokalizowany między trzema atomami tlenu, ponieważ wiązanie C-OH jest deprotonowane i dlatego może otrzymać ładunek ujemny przez rezonans.
Geometrie tych jonów można uznać za sfery wapnia otoczone płaskimi trójkątami węglanów z uwodornionym końcem. Pod względem wielkości wapń jest zauważalnie mniejszy niż jony HCO.3-.
Wodne roztwory
Ca (HCO3)dwa Nie może tworzyć krystalicznych ciał stałych, a właściwie składa się z wodnych roztworów tej soli. W nich jony nie są same, jak na obrazku, ale otoczone cząsteczkami H.dwaLUB.
Jak wchodzą w interakcje? Każdy jon otoczony jest kulą hydratacyjną, która będzie zależała od metalu, polarności i struktury rozpuszczonych form..
Okołodwa+ koordynuje się z atomami tlenu w wodzie, tworząc wodny kompleks Ca (OHdwa)ndwa+, gdzie n jest ogólnie uważane za sześć; to znaczy „wodny ośmiościan” wokół wapnia.
Podczas gdy aniony HCO3- oddziałują z wiązaniami wodorowymi (OdwaCO-H-OHdwa) lub z atomami wodoru wody w kierunku zdelokalizowanego ładunku ujemnego (HOCOdwa- H-OH, oddziaływanie dipol-jon).
Te interakcje między Cadwa+, HCO3- a woda jest tak wydajna, że sprawia, że wodorowęglan wapnia jest bardzo dobrze rozpuszczalny w tym rozpuszczalniku; w przeciwieństwie do CaCO3, w którym przyciąganie elektrostatyczne między Cadwa+ i CO3dwa- są bardzo mocne, wytrącają się z roztworu wodnego.
Oprócz wody są tam cząsteczki COdwa wokół, które reagują powoli, aby zapewnić więcej HCO3- (w zależności od wartości pH).
Hipotetyczna bryła
Jak dotąd rozmiary i ładunki jonów w Ca (HCO3)dwa, ani obecność wody, wyjaśnij, dlaczego substancja stała nie istnieje; to znaczy czyste kryształy, które można scharakteryzować metodą krystalografii rentgenowskiej. Ca (HCO3)dwa to nic innego jak jony obecne w wodzie, z której nadal wyrastają jamiste formacje.
Tak Cadwa+ i HCO3- można odizolować od wody, unikając następującej reakcji chemicznej:
Ca (HCO3)dwa(aq) → CaCO3(s) + COdwa(g) + HdwaO (l)
Można je następnie pogrupować w białą krystaliczną substancję stałą o stosunkach stechiometrycznych 2: 1 (2HCO3/ 1Ca). Nie ma badań na temat jego struktury, ale można ją porównać do struktury NaHCO3 (ponieważ wodorowęglan magnezu, Mg (HCO3)dwa, nie istnieje również jako ciało stałe) lub z CaCO3.
Stabilność: NaHCO3 vs Ca (HCO3)dwa
NaHCO3 krystalizuje w układzie jednoskośnym i CaCO3 w układach trygonalnych (kalcyt) i rombowych (aragonit). Jeśli podstawiono Na+ przez Cadwa+, sieć krystaliczna byłaby destabilizowana przez większą różnicę rozmiarów; to znaczy Na+ będąc mniejszym, tworzy bardziej stabilny kryształ z HCO3- w porównaniu do Cadwa+.
W rzeczywistości Ca (HCO3)dwa(aq) potrzebuje wody do odparowania, aby jej jony mogły grupować się w krysztale; ale jego sieć krystaliczna nie jest wystarczająco mocna, aby to zrobić w temperaturze pokojowej. Podczas podgrzewania wody zachodzi reakcja rozkładu (równanie powyżej).
Będąc jonem Na+ w roztworze utworzyłby kryształ z HCO3- przed jego termicznym rozkładem.
Powód, dla którego Ca (HCO3)dwa nie krystalizuje (teoretycznie), wynika to z różnicy promieni jonowych lub rozmiarów jonów, które nie mogą tworzyć stabilnego kryształu przed rozkładem.
Ca (HCO3)dwa vs CaCO3
Jeśli z drugiej strony H.+ do struktur krystalicznych CaCO3, ich właściwości fizyczne uległyby drastycznej zmianie. Być może ich temperatury topnienia znacznie spadają, a nawet morfologia kryształów zostaje zmodyfikowana..
Czy warto byłoby spróbować syntezy Ca (HCO3)dwa solidny? Trudności mogą przekroczyć oczekiwania, a sól o niskiej trwałości strukturalnej może nie zapewnić znaczących dodatkowych korzyści w żadnym zastosowaniu, w którym inne sole są już używane..
Fizyczne i chemiczne właściwości
Wzór chemiczny
Ca (HCO3)dwa
Waga molekularna
162,11 g / mol
Stan fizyczny
Nie występuje w stanie stałym. Występuje w roztworze wodnym i próby przekształcenia go w ciało stałe przez odparowanie wody nie powiodły się, ponieważ staje się węglanem wapnia.
Rozpuszczalność w wodzie
16,1 g / 100 ml w 0 ° C; 16,6 g / 100 ml przy 20º C i 18,4 g / 100 ml przy 100º C. Te wartości wskazują na wysokie powinowactwo cząsteczek wody do jonów Ca (HCO3)dwa, jak wyjaśniono w poprzedniej sekcji. Tymczasem tylko 15 mg CaCO3 rozpuszczają się w jednym litrze wody, odzwierciedlając ich silne oddziaływania elektrostatyczne.
Ponieważ Ca (HCO3)dwa nie może tworzyć ciała stałego, jego rozpuszczalności nie można określić doświadczalnie. Jednak biorąc pod uwagę warunki stworzone przez COdwa rozpuszczony w wodzie otaczającej wapień, można było obliczyć masę wapnia rozpuszczonego w temperaturze T; masa, która byłaby równa stężeniu Ca (HCO3)dwa.
W różnych temperaturach rozpuszczona masa rośnie, jak pokazują wartości w 0, 20 i 100 ° C. Następnie, zgodnie z tymi eksperymentami, określa się, ile Ca (HCO3)dwa rozpuszcza się w pobliżu CaCO3 w środowisku wodnym napowietrzonym COdwa. Gdy CO wydostanie siędwa gazowy, CaCO3 wytrąci się, ale nie Ca (HCO3)dwa.
Temperatura topnienia i wrzenia
Sieć krystaliczna Ca (HCO3)dwa jest znacznie słabszy niż CaCO3. Jeśli można go uzyskać w stanie stałym, a temperaturę, w której topi się mierzy się za pomocą fuzjometru, z pewnością uzyskano by wartość znacznie poniżej 899ºC. Podobnie, tego samego można by oczekiwać przy określaniu temperatury wrzenia..
Punkt spalania
Nie paliwo.
Ryzyka
Ponieważ związek ten nie występuje w postaci stałej, jest mało prawdopodobne, aby manipulowanie jego roztworami wodnymi stwarzało zagrożenie, ponieważ oba jony Cadwa+ jako HCO3- nie są szkodliwe w niskich stężeniach; a zatem większe ryzyko, jakie byłoby połknięcie tych roztworów, mogłoby być spowodowane jedynie spożyciem niebezpiecznej dawki wapnia.
Gdyby związek miał utworzyć ciało stałe, chociaż być może fizycznie różne od CaCO3, jej toksyczne działanie nie może wykraczać poza zwykły dyskomfort i suchość po kontakcie fizycznym lub inhalacji.
Aplikacje
-Roztwory wodorowęglanu wapnia są od dawna używane do zmywania starego papieru, zwłaszcza dzieł sztuki lub dokumentów o znaczeniu historycznym..
-Stosowanie roztworów wodorowęglanów jest przydatne nie tylko dlatego, że neutralizują kwasy w papierze, ale także zapewniają alkaliczną rezerwę węglanu wapnia. Ten ostatni związek zapewnia ochronę przed przyszłym uszkodzeniem papieru..
-Podobnie jak inne wodorowęglany, jest stosowany w drożdżach chemicznych oraz w musujących tabletkach lub proszkach. Ponadto wodorowęglan wapnia jest stosowany jako dodatek do żywności (wodne roztwory tej soli).
-W profilaktyce osteoporozy zastosowano roztwory wodorowęglanowe. Jednak w jednym przypadku zaobserwowano skutki uboczne, takie jak hiperkalcemia, zasadowica metaboliczna i niewydolność nerek..
-Czasami dożylnie podaje się wodorowęglan wapnia, aby skorygować depresyjny wpływ hipokaliemii na czynność serca.
-I wreszcie dostarcza organizmowi wapnia, który jest mediatorem skurczu mięśni, jednocześnie korygując kwasicę, która może wystąpić w stanie hipokaliemii..
Bibliografia
- Wikipedia. (2018). Wodorowęglan wapnia. Zaczerpnięte z: en.wikipedia.org
- Sirah Dubois. (03 października 2017). Co to jest wodorowęglan wapnia? Odzyskany z: livestrong.com
- Science Learning Hub. (2018). Chemia węglanów. Odzyskany z: sciencelearn.org.nz
- PubChem. (2018). Wodorowęglan wapnia. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Amy E. Gerbracht i Irene Brückle. (1997). Zastosowanie roztworów wodorowęglanu wapnia i wodorowęglanu magnezu w małych warsztatach konserwatorskich: wyniki ankiety. Odzyskany z: cool.conservation-us.org


Jeszcze bez komentarzy