
Zmiany typów stanów i ich charakterystyki (z przykładami)

Plik zmiany stanu lub faza to zjawisko termodynamiczne, w którym materia podlega odwracalnym zmianom fizycznym. Mówi się, że jest termodynamiczny, ponieważ przenoszenie ciepła zachodzi między materią a otoczeniem; lub co jest tym samym, istnieją interakcje między materią a energią, które powodują przegrupowanie cząstek.
Cząsteczki, które ulegają zmianie stanu, pozostają takie same przed i po zmianie. Ciśnienie i temperatura są ważnymi zmiennymi w sposobie, w jaki są uwzględniane w tej czy innej fazie. Kiedy następuje zmiana stanu, powstaje układ dwufazowy, złożony z tej samej materii w dwóch różnych stanach fizycznych.
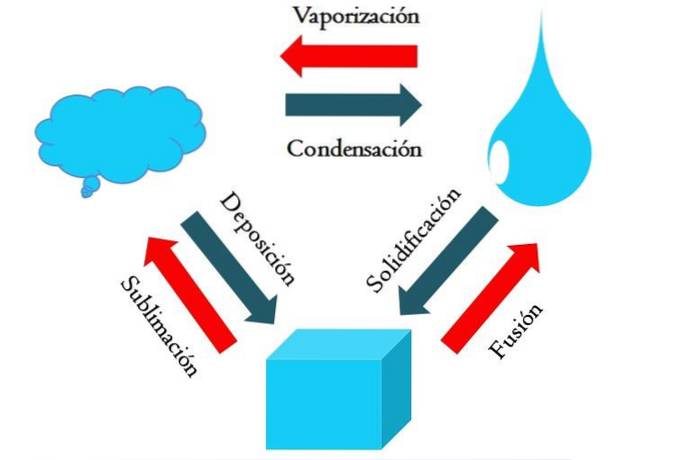
Powyższy obrazek pokazuje główne zmiany stanu, którym materia przechodzi w normalnych warunkach..
Stały sześcian niebieskawej substancji może zmienić stan ciekły lub gazowy w zależności od temperatury i ciśnienia otoczenia. Sam w sobie reprezentuje jedną fazę: ciało stałe. Ale w momencie topnienia, to znaczy topnienia, ustala się równowaga ciało stałe-ciecz zwana fuzją (czerwona strzałka między niebieskawym sześcianem a kroplą).
Aby doszło do fuzji, sześcian musi wchłonąć ciepło z otoczenia, aby podnieść swoją temperaturę; dlatego jest to proces endotermiczny. Gdy kostka zostanie całkowicie stopiona, wraca do jednej fazy: stanu ciekłego.
Ta niebieskawa kropla może nadal pochłaniać ciepło, co powoduje wzrost temperatury i powstawanie pęcherzyków gazowych. Ponownie, istnieją dwie fazy: jedna ciecz i druga gaz. Kiedy cała ciecz odparuje do punktu wrzenia, mówi się, że zagotowała się lub odparowała..
Teraz niebieskawe krople zamieniły się w chmury. Jak dotąd wszystkie procesy przebiegały endotermicznie. Niebieski gaz może nadal pochłaniać ciepło, aż stanie się gorący; Jednak biorąc pod uwagę warunki lądowe, ma on tendencję do ochładzania się i kondensacji z powrotem w ciecz (kondensacja)..
Z drugiej strony chmury mogą również osadzać się bezpośrednio na fazie stałej, ponownie tworząc stały sześcian (osadzanie). Te dwa ostatnie procesy są egzotermiczne (niebieskie strzałki); to znaczy, uwalniają ciepło do otoczenia lub otoczenia.
Oprócz kondensacji i osadzania, zmiana stanu następuje, gdy niebieskawe krople zamarzają w niskich temperaturach (krzepnięcie).
Indeks artykułów
- 1 Rodzaje zmian stanu i ich charakterystyka
- 1.1 - Fuzja
- 1.2 - Odparowanie
- 1.3 - Kondensacja
- 1.4 - Zestalenie
- 1.5 - Sublimacja
- 1.6 - Złożenie
- 2 Inne zmiany statusu
- 3 Odnośniki
Rodzaje zmian stanu i ich charakterystyka
Obraz przedstawia typowe zmiany dla trzech (najbardziej powszechnych) stanów skupienia materii: ciała stałego, cieczy i gazu. Zmiany, którym towarzyszą czerwone strzałki, mają charakter endotermiczny, polegający na pochłanianiu ciepła; podczas gdy te, którym towarzyszą niebieskie strzałki, są egzotermiczne, uwalniają ciepło.
Krótki opis każdej z tych zmian zostanie przedstawiony poniżej, podkreślając niektóre ich cechy wynikające z rozumowania molekularnego i termodynamicznego..
- Połączenie
Fuzja to zmiana stanu substancji ze stanu stałego na ciekły..
W stanie stałym cząsteczki (jony, molekuły, klastry, itp.) Są „więźniami”, umieszczonymi w ustalonych pozycjach w przestrzeni, bez możliwości swobodnego poruszania się. Są jednak zdolne do wibrowania z różnymi częstotliwościami, a jeśli są bardzo silne, rygorystyczny porządek narzucony przez siły międzycząsteczkowe zacznie się „rozpadać”..
W rezultacie uzyskuje się dwie fazy: jedną, w której cząstki pozostają zamknięte (ciało stałe), i drugą, w której są bardziej swobodne (płynne), na tyle, aby zwiększyć odległości, które je rozdzielają. Aby to osiągnąć, ciało stałe musi absorbować ciepło, a jego cząsteczki będą wibrować z większą siłą..
Z tego powodu fuzja jest endotermiczna, a kiedy się zaczyna, mówi się, że zachodzi równowaga między fazami ciało stałe-ciecz..
Ciepło niezbędne do wywołania tej zmiany nazywane jest ciepłem lub molową entalpią fuzji (ΔHFus). Wyraża ilość ciepła (energii, głównie w kJ), którą mol substancji w stanie stałym musi wchłonąć, aby się stopić, a nie po prostu podnieść jej temperaturę.
Śnieżna kula

Mając to na uwadze, należy rozumieć, dlaczego kula śnieżna topi się w dłoni (górne zdjęcie). Śnieg pochłania ciepło ciała, co wystarcza do podniesienia temperatury śniegu powyżej 0 ° C.
Kryształy lodu w śniegu pochłaniają wystarczającą ilość ciepła, aby się stopić, a ich cząsteczki wody przybrały bardziej nieuporządkowaną strukturę. Podczas topnienia śniegu utworzona woda nie podniesie swojej temperatury, ponieważ całe ciepło z dłoni jest wykorzystywane przez śnieg do całkowitego topnienia.
- Odparowanie

Waporyzacja to zmiana stanu substancji ze stanu ciekłego na gazowy.
Kontynuując przykład wody, teraz umieszczając garść śniegu w garnku i rozpalając ognisko, obserwuje się, że śnieg szybko topnieje. Gdy woda się nagrzewa, w jej wnętrzu zaczynają tworzyć się małe pęcherzyki dwutlenku węgla i innych ewentualnych zanieczyszczeń gazowych..

Ciepło molekularnie rozszerza nieuporządkowane konfiguracje wody, zwiększając jej objętość i zwiększając prężność pary; w związku z tym istnieje kilka cząsteczek, które uciekają z powierzchni w wyniku zwiększonego parowania.
Ciekła woda powoli podnosi swoją temperaturę ze względu na wysokie ciepło właściwe (4,184J / ° C ∙ g). Przychodzi moment, w którym pochłaniane ciepło nie jest już wykorzystywane do podniesienia temperatury, ale do zapoczątkowania równowagi ciecz-para; to znaczy zaczyna wrzeć i cała ciecz przejdzie do stanu gazowego pochłaniając ciepło i utrzymując stałą temperaturę.
W tym miejscu widać intensywne bulgotanie na powierzchni przegotowanej wody (górne zdjęcie). Ciepło pochłonięte przez wodę w stanie ciekłym do tego stopnia, że prężność jej początkowych pęcherzyków jest równa ciśnieniu zewnętrznemu, nazywane jest entalpią parowania (ΔHPara).
Rola nacisku
Presja ma również decydujące znaczenie dla zmian stanu. Jaki ma wpływ na waporyzację? Że im wyższe ciśnienie, tym większe ciepło, które woda musi pochłonąć, aby wrzeć, a zatem paruje powyżej 100 ° C.
Dzieje się tak, ponieważ wzrost ciśnienia utrudnia cząsteczkom wody ucieczkę z cieczy do fazy gazowej..
Szybkowary wykorzystują ten fakt na swoją korzyść do podgrzewania żywności w wodzie do temperatury powyżej jej punktu wrzenia..
Z drugiej strony, ponieważ występuje próżnia lub spadek ciśnienia, woda w stanie ciekłym potrzebuje niższej temperatury do wrzenia i przejścia w fazę gazową. Przy dużym lub małym ciśnieniu, gdy woda wrze, musi wchłonąć odpowiednie ciepło parowania, aby zakończyć zmianę stanu..
- Kondensacja
Kondensacja to zmiana stanu substancji ze stanu gazowego na ciekły.

Woda odparowała. Co dalej? Para wodna może nadal podnosić swoją temperaturę, stając się niebezpiecznym prądem mogącym spowodować poważne oparzenia..
Załóżmy jednak, że zamiast tego ostygnie. W jaki sposób? Mówi się, że uwalnianie ciepła do otoczenia i uwalnianie ciepła jest procesem egzotermicznym.
Uwalniając ciepło, bardzo energetyczne cząsteczki wody w stanie gazowym zaczynają zwalniać. Ponadto ich interakcje stają się bardziej efektywne wraz ze spadkiem temperatury pary. Najpierw utworzą się kropelki wody, skroplone z pary, a następnie większe krople, które zostaną przyciągnięte przez grawitację.
Aby w pełni skondensować określoną ilość pary, należy uwolnić tę samą energię, ale z przeciwnym znakiem, przy ΔHPara; to znaczy jego entalpia kondensacji ΔHCond. W ten sposób ustala się odwrotna równowaga para-ciecz.
Wilgotne okna

Kondensację można zobaczyć na samych oknach domów. W zimnym klimacie para wodna zawarta we wnętrzu domu zderza się z oknem, które ze względu na swój materiał ma niższą temperaturę niż inne powierzchnie..
Tam cząsteczki pary łatwiej się zlepiają, tworząc cienką białawą warstwę, którą można łatwo usunąć ręcznie. Gdy te cząsteczki uwalniają ciepło (ogrzewając szkło i powietrze), zaczynają tworzyć liczniejsze skupiska, aż pierwsze krople ulegną kondensacji (górne zdjęcie).
Kiedy krople stają się bardzo duże, ześlizgują się po oknie i zostawiają ślady wody.
- Zestalenie
Krzepnięcie to zmiana stanu substancji ze stanu ciekłego na stały.

Zestalenie następuje w wyniku chłodzenia; innymi słowy, woda zamarza. Aby zamarznąć, woda musi uwalniać taką samą ilość ciepła, jaką lód pochłania, aby się stopić. Ponownie, ciepło to nazywane jest entalpią krzepnięcia lub zamarzania, ΔHCong (-ΔHFus).
Gdy cząsteczki wody ostygną, tracą energię, a ich interakcje międzycząsteczkowe stają się silniejsze i bardziej kierunkowe. W efekcie układają się dzięki wiązaniom wodorowym i tworzą tzw. Kryształki lodu. Mechanizm wzrostu kryształków lodu ma wpływ na ich wygląd: przezroczysty lub biały.

Jeśli kryształki lodu rosną bardzo wolno, nie zatykają zanieczyszczeń, takich jak gazy, które rozpuszczają się w wodzie w niskich temperaturach. W ten sposób bąbelki uciekają i nie mogą wchodzić w interakcje ze światłem; a co za tym idzie, masz lód tak przezroczysty jak niezwykły lodowy posąg (górne zdjęcie).
To samo, co dzieje się z lodem, może się zdarzyć z każdą inną substancją, która zestala się przez chłodzenie. Być może jest to najbardziej złożona fizyczna zmiana warunków ziemskich, ponieważ można uzyskać kilka polimorfów.
- Sublimacja
Sublimacja to zmiana stanu substancji ze stanu stałego na gazowy.
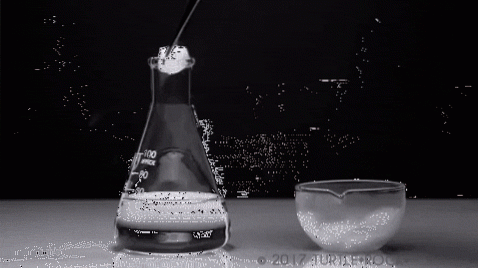
Czy można sublimować wodę? Nie, przynajmniej nie w normalnych warunkach (T = 25 ° C, P = 1 atm). Aby nastąpiła sublimacja, czyli zmiana stanu ze stałego na gazowy, prężność pary ciała stałego musi być wysoka.
Podobnie istotne jest, aby ich siły międzycząsteczkowe nie były zbyt silne, najlepiej jeśli składają się one tylko z sił dyspersyjnych.
Najbardziej charakterystycznym przykładem jest jod w postaci stałej. Jest to krystaliczna substancja stała o szaro-fioletowych odcieniach, charakteryzująca się wysoką prężnością pary. Do tego stopnia, że w jego trakcie wydziela się purpurowa para, której objętość i ekspansja stają się zauważalne po podgrzaniu..

Typowy eksperyment pokazano na powyższym obrazku, w którym stały jod jest odparowywany w szklanym pojemniku. Interesujące i uderzające jest obserwowanie, jak fioletowe opary są rozpraszane, a inicjowany uczeń może zweryfikować brak ciekłego jodu.
To główna cecha sublimacji: nie ma fazy ciekłej. Podobnie jest endotermiczna, ponieważ ciało stałe absorbuje ciepło, aby zwiększyć swoją prężność pary, aż zrówna się z ciśnieniem zewnętrznym..
- Zeznanie

Osadzanie to zmiana stanu substancji ze stanu gazowego na stały.
Równolegle do eksperymentu z sublimacją jodu następuje jego osadzanie. Osadzanie jest odwrotną zmianą lub przejściem: substancja przechodzi ze stanu gazowego do ciała stałego bez tworzenia fazy ciekłej.
Kiedy opary fioletowego jodu wchodzą w kontakt z zimną powierzchnią, uwalniają ciepło, aby ją ogrzać, tracąc energię i przegrupowując swoje cząsteczki z powrotem w szaro-fioletową substancję stałą (górne zdjęcie). Jest to wtedy proces egzotermiczny.
Osadzanie jest szeroko stosowane do syntezy materiałów, w których są one domieszkowane atomami metali przy użyciu zaawansowanych technik. Jeśli powierzchnia jest bardzo zimna, wymiana ciepła między nią a cząstkami pary jest gwałtowna, z pominięciem przejścia przez odpowiednią fazę ciekłą..
Ciepło lub entalpia osadzania (i nie kaucja) jest odwrotnością sublimacji (ΔHPod= - ΔHD.E.P). Teoretycznie wiele substancji można sublimować, ale aby to osiągnąć, konieczne jest manipulowanie ciśnieniami i temperaturami, oprócz posiadania pod ręką ich wykresu P vs T; w którym można wizualizować jej odległe możliwe fazy.
Inne zmiany statusu
Chociaż nie ma o nich żadnej wzmianki, istnieją inne stany skupienia. Czasami charakteryzują się tym, że mają „po trochu każdego”, a zatem są ich połączeniem. Aby je wygenerować, należy manipulować ciśnieniami i temperaturami do bardzo dodatnich (dużych) lub ujemnych (małych) wielkości..
Tak więc, na przykład, jeśli gazy zostaną nadmiernie ogrzane, stracą elektrony, a dodatnio naładowane jądra w tym ujemnym przypływie utworzą coś, co jest znane jako plazma. Jest synonimem „gazu elektrycznego”, ponieważ ma wysoką przewodność elektryczną.
Z drugiej strony, gdy temperatura spada zbyt nisko, materia może zachowywać się w nieoczekiwany sposób; to znaczy wykazują unikalne właściwości w okolicy zera absolutnego (0 K).
Jedną z tych właściwości jest nadciekłość i nadprzewodnictwo; a także powstawanie kondensatów Bosego-Einsteina, w których wszystkie atomy zachowują się jak jeden.
Niektóre badania wskazują nawet na materię fotoniczną. W nich cząsteczki promieniowania elektromagnetycznego, fotony, grupują się, tworząc cząsteczki fotoniczne. Oznacza to, że teoretycznie dawałoby masę ciałom świetlnym.
Bibliografia
- Helmenstine, dr Anne Marie (19 listopada 2018). Lista zmian fazowych między stanami materii. Odzyskany z: thinkco.com
- Wikipedia. (2019). Stan skupienia. Odzyskane z: en.wikipedia.org
- Dorling Kindersley. (2007). Zmieniające się stany. Odzyskany z: factmonster.com
- Meyers Ami. (2019). Zmiana fazy: parowanie, kondensacja, zamrażanie, topienie, sublimacja i osadzanie. Nauka. Odzyskany z: study.com
- Bagley M. (11 kwietnia 2016). Materia: definicja i pięć stanów materii. Odzyskane z: livescience.com
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.



Jeszcze bez komentarzy