
Warstwa Valencia, z czego się składa, przykłady
Plik Przylądek Walencji To taki, którego elektrony są odpowiedzialne za właściwości chemiczne pierwiastka. Elektrony w tej powłoce oddziałują z elektronami sąsiedniego atomu, tworząc w ten sposób wiązania kowalencyjne (A-B); a jeśli migrują z jednego atomu do drugiego, bardziej elektroujemne, wiązania jonowe (A + B-).
Warstwę tę określa główna liczba kwantowa n, co z kolei wskazuje okres, w którym element znajduje się w układzie okresowym. Podczas gdy kolejność grupowa zależy od liczby elektronów krążących w powłoce walencyjnej. Więc dla n równa 2, może zajmować osiem elektronów: osiem grup (1-8).
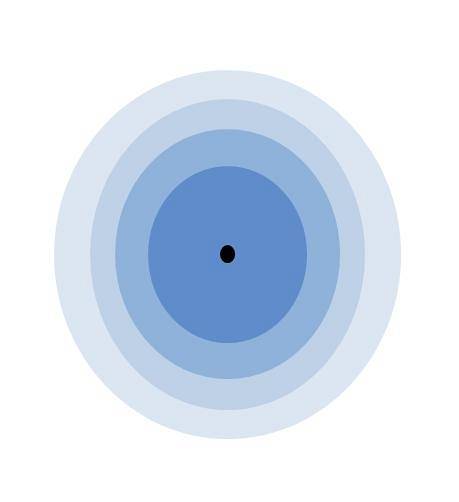
Powyższy obrazek ilustruje znaczenie warstwy walencyjnej. Czarny punkt w środku atomu to jądro, podczas gdy pozostałe koncentryczne okręgi to powłoki elektronowe zdefiniowane przez n.
Ile warstw ma ten atom? Każdy z nich ma swój własny kolor, a ponieważ jest ich cztery, atom ma cztery warstwy (n= 4). Należy również zauważyć, że kolor pogarsza się wraz ze wzrostem odległości od warstwy do rdzenia. Warstwa walencyjna to ta, która jest najbardziej oddalona od jądra: ta o najjaśniejszym kolorze.
Indeks artykułów
- 1 Co to jest warstwa walencyjna?
- 2 Funkcje
- 3 przykłady
- 3.1 Przykład 1
- 3.2 Przykład 2
- 4 Odnośniki
Co to jest warstwa walencyjna?
Zgodnie z obrazem powłoka walencyjna to nic innego jak ostatnie orbitale atomu zajmowane przez elektrony. W jasnoniebieskiej pelerynie do n= 4, istnieje szereg orbitali 4s, 4p, 4d i 4f; to znaczy wewnątrz znajdują się inne podwarstwy o różnych możliwościach elektronicznych.
Atom potrzebuje elektronów, aby wypełnić wszystkie orbitale 4n. Proces ten można zaobserwować w konfiguracjach elektronicznych elementów na przestrzeni czasu.
Na przykład potas ma konfigurację elektronów [Ar] 4s1, podczas gdy wapń, po jego prawej stronie, [Ar] 4sdwa. Jaka jest warstwa walencyjna według tych ustawień? Termin [Ar] odnosi się do konfiguracji elektronicznej argonu 1s gazu szlachetnegodwa2sdwa2 P63sdwa3p6. Reprezentuje warstwę wewnętrzną lub zamkniętą (znaną również jako jądro).
Ponieważ orbital 4s jest orbitalem o największej energii i do którego wchodzą nowe elektrony, reprezentuje on powłokę walencyjną zarówno dla K, jak i Ca. Gdyby porównać atomy K i Ca z atomem na obrazku, [Ar] wszystkie wewnętrzne warstwy powinny mieć kolor niebieski; i 4s jasnoniebieska warstwa zewnętrzna.
Charakterystyka
Z powyższego można podsumować niektóre cechy powłoki walencyjnej dla wszystkich atomów:
-Twój poziom energii jest wyższy; co jest tym samym, jest dalej usuwany z rdzenia i ma najniższą gęstość elektronową (w porównaniu z innymi warstwami).
-To jest niekompletne. Dlatego będzie nadal wypełniał się elektronami, gdy okres będzie przechodził od lewej do prawej w układzie okresowym..
-Przyczynia się do tworzenia wiązań kowalencyjnych lub jonowych.
W przypadku metali, potasu i wapnia, ulegają one utlenieniu do postaci kationów. K+ ma konfigurację elektronową [Ar], ze względu na utratę jedynego zewnętrznego elektronu 4s1. A po stronie Cadwa+, jego konfiguracja to również [Ar]; ponieważ zamiast stracić jeden elektron, tracisz dwa (4sdwa).
Ale jaka jest różnica między K+ i Cadwa+, czy obaj stracą elektrony ze swojej powłoki walencyjnej i mają konfigurację elektronów [Ar]? Różnica polega na ich promieniach jonowych. ACdwa+ jest mniejsza niż K.+, ponieważ atom wapnia ma dodatkowy proton, który przyciąga zewnętrzne elektrony z większą siłą (powłoki zamknięte lub walencyjne).
Warstwa walencyjna 4s nie zniknęła: jest pusta tylko dla tych jonów.
Przykłady
Pojęcie powłoki walencyjnej można znaleźć bezpośrednio lub pośrednio w wielu aspektach chemii. Ponieważ jego elektrony to te, które uczestniczą w tworzeniu wiązań, każdy temat, który ich dotyczy (TEV, RPECV, mechanizmy reakcji itp.) Powinien odnosić się do tej warstwy.
Dzieje się tak, ponieważ ważniejsze od powłoki walencyjnej są jej elektrony; zwane elektronami walencyjnymi. Przedstawione w postępowej konstrukcji konfiguracji elektronowych, określają one strukturę elektronową atomu, a tym samym jego właściwości chemiczne..
Na podstawie tych informacji o atomie A i innym B można zarysować struktury ich związków za pomocą struktur Lewisa. Podobnie struktury elektronowe i molekularne szeregu związków można określić dzięki liczbie elektronów walencyjnych..
Najprostsze i możliwe przykłady warstw walencyjnych znajdują się w układzie okresowym; w szczególności w konfiguracjach elektronowych.
Przykład 1
Możliwe jest zidentyfikowanie pierwiastka i jego lokalizacji w układzie okresowym tylko z konfiguracją elektronów. Tak więc, jeśli element X ma konfigurację [Kr] 5sdwa5 pkt1, Co to jest i do jakiego okresu i grupy należy?
Biorąc pod uwagę n= 5, X jest w piątym okresie. Ponadto ma trzy elektrony walencyjne: dwa na orbicie 5sdwa i jeden w 5p1. Warstwa wewnętrzna [Kr] nie dostarcza więcej informacji.
Ponieważ X ma trzy elektrony, a jego orbitale 5p są niekompletne, znajduje się w bloku p; ponadto w grupie IIIA (system romański) lub 13 (aktualny system numeracji i zatwierdzony przez IUPAC). X jest wtedy elementem Indian, In.
Przykład 2
Czym jest pierwiastek X o konfiguracji elektronowej [Kr] 4d105s1? Zauważ, że podobnie jak In, należy on do okresu 5, od orbity 5s1 to ten o największej energii. Jednak powłoka walencyjna obejmuje również orbitale 4d, ponieważ tak jest niekompletny.
Warstwy walencyjne można następnie oznaczyć jako nsnp, dla elementu bloku p lub s; lub (n-1) dns, dla elementu bloku d. Tak więc tajemniczy element X należy do bloku d, ponieważ jego konfiguracja elektroniczna jest typu (n-1) dns (4d105s1).
Do której grupy należysz? Dodanie dziesięciu elektronów orbitalu 4d10, i jeden z 5s1, X ma jedenaście elektronów walencyjnych. Dlatego należy go umieścić w grupie IB lub 11. Następnie, przechodząc przez okres 5 układu okresowego do grupy 11, natrafiamy na pierwiastek srebrny, Ag.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (wydanie czwarte, str. 23). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. Chemia. (8th ed.). CENGAGE Learning, s. 287.
- Centrum zasobów NDT. (s.f.). Skorupa walencyjna. Zaczerpnięte z: nde-ed.org
- Clackamas Community College. (2002). Elektrony walencyjne. Odzyskany z: dl.clackamas.edu
- Chemia LibreTexts. (s.f.). Elektrony walencyjne i rdzeniowe. Źródło: chem.libretexts.org



Jeszcze bez komentarzy