
Struktura węglanu glinu, właściwości, zastosowania

Plik węglan glinu to sól nieorganiczna, której wzór chemiczny to Aldwa(WSPÓŁ3)3. Jest to praktycznie nieistniejący węglan metalu, biorąc pod uwagę jego wysoką niestabilność w normalnych warunkach..
Wśród przyczyn jego niestabilności można wymienić słabe oddziaływania elektrostatyczne między jonami Al3+ i CO3dwa-, które teoretycznie powinny być bardzo silne ze względu na wielkość ich ładunków.
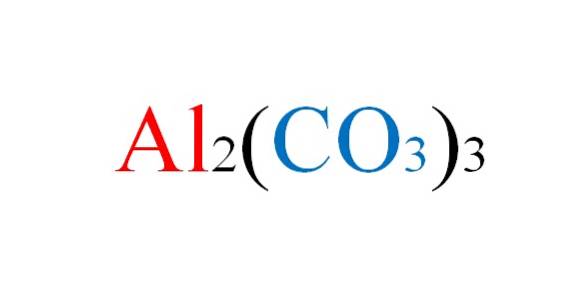
Sól nie napotyka żadnych niedogodności na papierze, gdy zapisuje się równania chemiczne jej reakcji; ale w praktyce obraca się przeciwko niemu.
Wbrew temu, co zostało powiedziane, węglan glinu może występować w towarzystwie innych jonów, jak ma to miejsce w przypadku mineralnego dawsonitu. Istnieje również pochodna, w której oddziałuje z wodnym amoniakiem. Resztę uważa się za mieszaninę między Al (OH)3 i HdwaWSPÓŁ3; co odpowiada musującemu roztworowi z białym osadem.
Ta mieszanina ma zastosowania lecznicze. Jednak do czystej, dającej się wyodrębnić i manipulowalnej soli Aldwa(WSPÓŁ3)3, brak znanych możliwych zastosowań; przynajmniej nie pod ogromnym ciśnieniem lub w ekstremalnych warunkach.
Indeks artykułów
- 1 Struktura węglanu glinu
- 1.1 Węglan wodorotlenku amonowo-glinowego
- 2 Właściwości
- 2.1 Masa molowa
- 2.2 Niestabilność
- 2.3 Fizyczne
- 3 Zastosowania
- 4 Odnośniki
Struktura węglanu glinu
Struktura krystaliczna tej soli jest nieznana, ponieważ jest tak niestabilna, że nie można jej scharakteryzować. Ze swojej formuły Aldwa(WSPÓŁ3)3, Wiadomo jednak, że udział jonów Al3+ i CO3dwa- wynosi 2: 3; to znaczy na każde dwa kationy Aldwa+ muszą być trzy aniony CO3dwa- oddziałując z nimi elektrostatycznie.
Problem polega na tym, że oba jony mają bardzo nierówną wielkość; Al3+ jest bardzo mały, gdy CO3dwa- jest nieporęczny. Ta różnica już sama w sobie wpływa na stabilność sieci krystalicznej, której jony oddziałują „niezgrabnie”, gdyby sól ta mogła zostać wyizolowana w stanie stałym.
Oprócz tego, Al3+ jest to silnie polaryzujący kation, właściwość, która deformuje elektroniczny obłok CO3dwa-. To tak, jakbyś chciał zmusić go do wiązania kowalencyjnego, nawet jeśli anion nie może..
W konsekwencji oddziaływania jonowe między Al3+ i CO3dwa- mają tendencję do kowalencji; kolejny czynnik, który przyczynia się do niestabilności Aldwa(WSPÓŁ3)3.
Węglan wodorotlenku amonowo-glinowego
Chaotyczny związek między Al3+ i CO3dwa- mięknie, gdy w szkle obecne są inne jony; takie jak NH4+ i OH-, z roztworu amoniaku. Ten kwartet jonów Al3+, WSPÓŁ3dwa-, NH4+ i OH-, udaje im się zdefiniować stabilne kryształy, zdolne nawet do przyjmowania różnych morfologii.
Inny podobny przykład można zaobserwować w minerale dawsonicie i jego rombowych kryształach, NaAlCO3(O)dwa, gdzie Na+ zastępuje NH4+. W tych solach ich wiązania jonowe są na tyle silne, że woda nie sprzyja uwalnianiu CO.dwa; a przynajmniej nie gwałtownie.
Chociaż NH4Al (OH)dwaWSPÓŁ3 (AACC, od angielskiego akronimu) ani NaAlCO3(O)dwa reprezentują węglan glinu, można je uznać za jego podstawowe pochodne.
Nieruchomości
Masa cząsteczkowa
233,98 g / mol.
Niestabilność
W poprzedniej sekcji wyjaśniono z perspektywy molekularnej, dlaczego Aldwa(WSPÓŁ3)3 jest niestabilny. Ale jakiej transformacji to przechodzi? Należy wziąć pod uwagę dwie sytuacje: jedną suchą, a drugą „mokrą”.
Suchy
W stanie suchym anion CO3dwa- wraca do COdwa przez następujący rozkład:
Dodwa(WSPÓŁ3)3 => AldwaLUB3 + 3COdwa
Co ma sens, jeśli jest syntetyzowany pod wysokim ciśnieniem CO.dwa; czyli odwrotna reakcja:
DodwaLUB3 + 3COdwa => Aldwa(WSPÓŁ3)3
Dlatego, aby zapobiec Aldwa(WSPÓŁ3)3 sól powinna być poddana działaniu wysokiego ciśnienia (przy użyciu Ndwa, na przykład). W ten sposób powstaje COdwa nie byłby faworyzowany termodynamicznie.
Mokry
Podczas mokrej nawierzchni CO3dwa- ulega hydrolizie, w wyniku której powstają niewielkie ilości OH-; ale wystarczy, aby wytrącić wodorotlenek glinu, Al (OH)3:
WSPÓŁ3dwa- + H.dwaLUB <=> HCO3- + O-
Do3+ + 3OH- <=> Al (OH)3
Z drugiej strony Al3+ hydrolizuje również:
Do3+ + H.dwaLUB <=> Al (OH)dwadwa+ + H.+
Chociaż glin faktycznie nawadni się jako pierwszy3+ tworząc kompleks Al (H.dwaLUB)63+, który jest hydrolizowany dając [Al (HdwaLUB)5O]dwa+ i H3LUB+. Następnie H.3O (lub H.+) proton do CO3dwa- do H.dwaWSPÓŁ3, który rozkłada się na COdwa i HdwaLUB:
WSPÓŁ3dwa- + 2H+ => H.dwaWSPÓŁ3
H.dwaWSPÓŁ3 <=> WSPÓŁdwa + H.dwaLUB
Zwróć uwagę, że w końcu Al3+ zachowuje się jak kwas (uwalnia H.+) i baza (uwalnia OH- z równowagą rozpuszczalności Al (OH)3); to znaczy wykazuje amfoterycyzm.
Fizyczny
Jeśli można ją wyodrębnić, ta sól prawdopodobnie będzie miała biały kolor, podobnie jak wiele innych soli glinu. Również ze względu na różnicę między jonowymi promieniami Al3+ i CO3dwa-, z pewnością miałby bardzo niską temperaturę topnienia lub wrzenia w porównaniu z innymi związkami jonowymi.
A jeśli chodzi o jego rozpuszczalność, byłby nieskończenie rozpuszczalny w wodzie. Ponadto byłby higroskopijnym i rozpływającym się ciałem stałym. Jednak to tylko domysły. Inne właściwości należałoby oszacować za pomocą modeli komputerowych poddanych działaniu wysokich ciśnień..
Aplikacje
Znane zastosowania węglanu glinu są medyczne. Był stosowany jako łagodny środek ściągający oraz jako lek na wrzody żołądka i stany zapalne. Jest również stosowany w celu zapobiegania tworzeniu się kamieni moczowych u ludzi..
Stosowano go w celu kontrolowania wzrostu zawartości fosforanów w organizmie, a także w leczeniu objawów zgagi, niestrawności i wrzodów żołądka..
Bibliografia
- XueHui L., Zhe T., YongMing C., RuiYu Z. & Chenguang L. (2012). Hydrotermalna synteza nanopłatków i nanowłókien wodorotlenku glinu amonowo-glinowego (AACH) Morfologie o kontrolowanym pH. Atlantis Press.
- Robin Lafficher, Mathieu Digne, Fabien Salvatori, Malika Boualleg, Didier Colson, Francois Puel (2017) Wodorotlenek węglanu amonu i glinu NH4Al (OH) 2CO3 jako alternatywna droga przygotowania tlenku glinu: porównanie z klasycznym prekursorem bemitu. Powder Technology, 320, 565-573, DOI: 10.1016 / j.powtec.2017.07.0080
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Węglan glinu. Baza danych PubChem., CID = 10353966. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Węglan glinu. Odzyskane z: en.wikipedia.org
- Siarczan glinu. (2019). Węglan glinu. Odzyskany z: aluminiumsulfate.net



Jeszcze bez komentarzy