
Właściwości cykloalkanów, reakcje, zastosowania, przykłady

Plik cykloalkany to rodzina węglowodorów nasyconych o ogólnym wzorze CnH.2n to pokrywa się z alkenami; z tą różnicą, że pozorne nienasycenie nie jest spowodowane podwójnym wiązaniem, ale pierścieniem lub cyklem. Dlatego są uważane za izomery alkenów.
Powstają, gdy liniowe alkany łączą końce swoich łańcuchów, tworząc zamkniętą strukturę. Podobnie jak w przypadku alkanów, cykloalkany mogą wykazywać różne rozmiary, masy cząsteczkowe, podstawienia lub nawet układy złożone z więcej niż jednego pierścienia (policykliczne).
Poza tym chemicznie i fizycznie są podobne do alkanów. Mają tylko węgle i wodory, są neutralnymi cząsteczkami i dlatego oddziałują za pośrednictwem sił Van der Wallsa. Służą również jako paliwo, uwalniając ciepło, gdy spalają się w obecności tlenu..
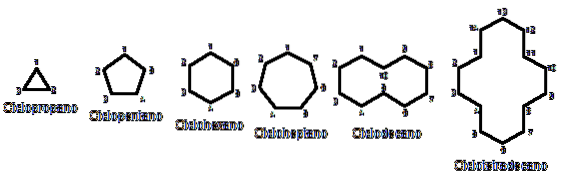
Dlaczego cykloalkany są bardziej niestabilne niż ich odpowiedniki z otwartym łańcuchem? Przyczynę można podejrzewać obserwując z lotu ptaka przykłady cykloalkanów przedstawionych na powyższym obrazku: istnieją steryczne (przestrzenne) napięcia i przeszkody.
Zauważ, że im mniej jest węgli (zaznaczonych na niebiesko), tym bardziej zamknięta jest struktura; a odwrotnie dzieje się, gdy rosną, stając się jak naszyjnik.
Małe cykloalkany są gazami, a wraz ze wzrostem ich rozmiarów zwiększają się ich siły międzycząsteczkowe. W konsekwencji mogą to być ciecze zdolne do rozpuszczania tłuszczów i niepolarnych cząsteczek, smarów lub ciał stałych, które mają ciemne kolory i właściwości podobne do asfaltu..
Indeks artykułów
- 1 Właściwości fizyczne i chemiczne
- 1.1 Biegunowość
- 1.2 Oddziaływania międzycząsteczkowe
- 1.3 Nasycenie
- 1.4 Stabilność
- 2 Nazewnictwo
- 3 Struktura
- 3.1 Zgodność
- 4 reakcje
- 5 zastosowań
- 6 Przykłady cykloalkanów
- 7 Referencje
Fizyczne i chemiczne właściwości
Biegunowość
Składając się wyłącznie z atomów węgla i wodorów, atomów, które same w sobie nie różnią się zbytnio elektroujemnością, powoduje to, że cząsteczki cykloalkanu są niepolarne, a zatem nie mają momentu dipolowego..
Nie mogą oddziaływać za pośrednictwem sił dipol-dipol, ale zależą w szczególności od sił Londynu, które są słabe, ale zwiększają się wraz z masą cząsteczkową. Dlatego małe cykloalkany (zawierające mniej niż pięć atomów węgla) są gazami..
Oddziaływania międzycząsteczkowe
Z drugiej strony, ponieważ są pierścieniami, cykloalkany mają większą powierzchnię kontaktu, co sprzyja siłom londyńskim między ich cząsteczkami. W ten sposób grupują się i oddziałują w lepszy sposób w porównaniu z alkanami; stąd też jego temperatura wrzenia i topnienia jest wyższa.
Ponadto, ponieważ mają o dwa atomy wodoru mniej (CnH.2n dla cykloalkanów i CnH.2n + 2 dla alkanów), są lżejsze; a dodając do tego fakt większej powierzchni styku, zmniejsza się objętość zajmowana przez jego cząsteczki, a zatem są one gęstsze.
Nasycenie
Dlaczego cykloalkany zalicza się do węglowodorów nasyconych? Ponieważ nie mają sposobu na włączenie cząsteczki wodoru; chyba że pierścień zostanie otwarty, w którym to przypadku staną się prostymi alkanami. Aby węglowodór mógł być uznany za nasycony, musi mieć maksymalną możliwą liczbę wiązań C-H.
Stabilność
Pod względem chemicznym są bardzo podobne do alkanów. Oba mają wiązania C-C i C-H, które nie są tak łatwe do zerwania w celu wytworzenia innych produktów. Jednak ich względne stabilności różnią się, co można zweryfikować eksperymentalnie, mierząc ich ciepło spalania (ΔHgrzebień).
Na przykład, porównując ΔHgrzebień dla propanu i cyklopropanu (reprezentowanych przez trójkąt na obrazku) mamy odpowiednio 527,4 kcal / mol i 498,9 kcal / mol.
Szczegół jest taki, że cyklopropan, oparty na cieple spalania alkanów, powinien mieć ΔHgrzebień niższe (471 kcal / mol), ponieważ są to trzy grupy metylenowe, CHdwa; ale w rzeczywistości uwalnia więcej ciepła, odzwierciedlając większą niestabilność niż szacowano. Mówi się, że ta nadwyżka energii jest spowodowana naprężeniami w pierścieniu..
W rzeczywistości te napięcia rządzą i różnicują reaktywność lub stabilność cykloalkanów w odniesieniu do alkanów w stosunku do określonych reakcji. Dopóki naprężenia nie są bardzo wysokie, cykloalkany wydają się być bardziej stabilne niż odpowiadające im alkany..
Nomenklatura
Nomenklatura IUPAC dla cykloalkanów nie różni się zbytnio od tej dla alkanów. Najprostszą zasadą jest umieszczenie przedrostka cyklo- do nazwy alkanu, z którego powstaje cykloalkan.
Tak więc, na przykład, z n-heksanu, CH3CHdwaCHdwaCHdwaCHdwaCH3, otrzymujesz cykloheksan (reprezentowany przez sześciokąt na pierwszym obrazku). To samo dzieje się z cyklopropanem, cyklobutanem itp..
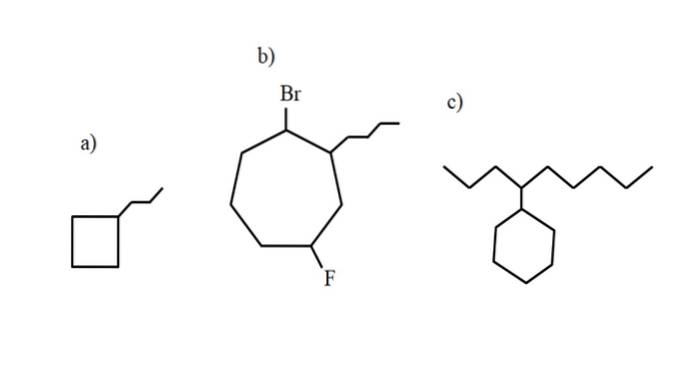
Jednak te związki mogą ulegać substytucji jednego z ich wodorów. Gdy liczba atomów węgla w pierścieniu jest większa niż liczba podstawników alkilowych, pierścień przyjmuje się jako łańcuch główny; tak jest w przypadku a) dla powyższego obrazu.
Należy zauważyć, że w a) cyklobutan (kwadrat) ma więcej atomów węgla niż przyłączona do niego grupa propylowa; wtedy ten związek jest nazwany propylocyklobutanem.
Jeśli jest więcej niż jeden podstawnik, należy je nazwać w kolejności alfabetycznej i tak, aby miały jak najmniejszy numer lokalizatora. Na przykład b) nazywa się: 1-bromo-4-fluoro-2-butylocykloheptan (a nie 1-bromo-5-fluoro-7-butylocykloheptan, co byłoby niepoprawne).
I wreszcie, gdy podstawnik alkilowy ma więcej atomów węgla niż pierścień, wówczas mówi się, że ten ostatni jest podstawnikiem łańcucha głównego. Tak więc c) nazywa się: 4-cykloheksylnonanem.
Struktura
Pomijając podstawione cykloalkany, wygodnie jest skupić się tylko na ich podstawach strukturalnych: pierścieniach. Zostały one przedstawione na pierwszym obrazku.
Obserwowanie ich może prowadzić do fałszywego przekonania, że takie cząsteczki są płaskie; ale z wyjątkiem cyklopropanu, jego powierzchnie są „zygzakowate”, a węgle wznoszą się lub opadają w stosunku do tej samej płaszczyzny.
Dzieje się tak, ponieważ na początku wszystkie węgle są hybrydyzowane.3, i dlatego przedstawiamy geometrie czworościenne z kątami wiązania 109,5º. Ale jeśli uważnie obserwuje się geometrię pierścieni, niemożliwe jest, aby ich kąty były takie; na przykład kąty w trójkącie cyklopropanu wynoszą 60º.
Nazywa się to naprężeniem kątowym. Im większe pierścienie, tym kąt między wiązaniami C-C jest bliższy 109,5 °, co powoduje zmniejszenie wspomnianego naprężenia i wzrost stabilności cykloalkanu..
Innym przykładem jest cyklobutan, którego kąty wiązania wynoszą 90º. Już w cyklopentanie jego kąty wynoszą 108º, a od cykloheksanu mówi się wtedy, że napięcie kątowe przestaje wywierać tak niezwykły efekt destabilizujący.
Konformacje
Oprócz naprężenia kątowego istnieją inne czynniki, które przyczyniają się do naprężenia doświadczanego przez cykloalkany..
Wiązania C-C nie mogą po prostu się obracać, ponieważ oznaczałoby to, że cała struktura będzie się „trząść”. Zatem cząsteczki te mogą przyjmować bardzo dobrze określone konformacje przestrzenne. Celem tych ruchów jest zmniejszenie naprężeń spowodowanych zaćmieniem atomów wodoru; to znaczy, kiedy są przed sobą.
Na przykład konformacje cyklobutanu przypominają motyla trzepoczącego skrzydłami; te z cyklopentanu, otoczka; te z cykloheksanu, łodzi lub krzesła, a im większy pierścień, tym większa liczba i kształty, które mogą przyjąć w przestrzeni.
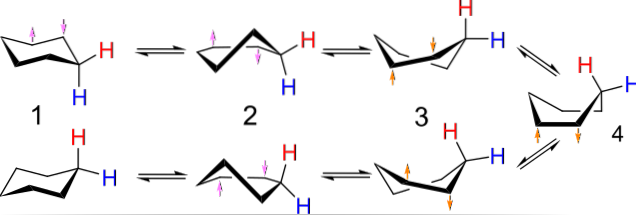
Powyższy obrazek przedstawia przykład takich konformacji dla cykloheksanu. Zwróć uwagę, że rzekomy płaski sześciokąt w rzeczywistości bardziej przypomina krzesło (po lewej stronie obrazu) lub łódź (po prawej). Jeden wodór jest reprezentowany przez czerwoną literę, a drugi przez niebieską, aby wskazać, jak ich względne pozycje zmieniają się po odwróceniach..
W (1), kiedy wodór jest prostopadły do płaszczyzny pierścienia, mówi się, że znajduje się w położeniu osiowym; a kiedy jest równoległy do tego, mówi się, że znajduje się w pozycji równikowej.
Reakcje
Reakcje, którym mogą podlegać cykloalkany, są takie same jak w przypadku alkanów. Oba spalają się w obecności nadmiaru tlenu w typowych reakcjach spalania z wytworzeniem dwutlenku węgla i wody. Podobnie, oba mogą ulegać halogenowaniu, w którym wodór jest zastępowany atomem halogenu (F, Cl, Br, I).
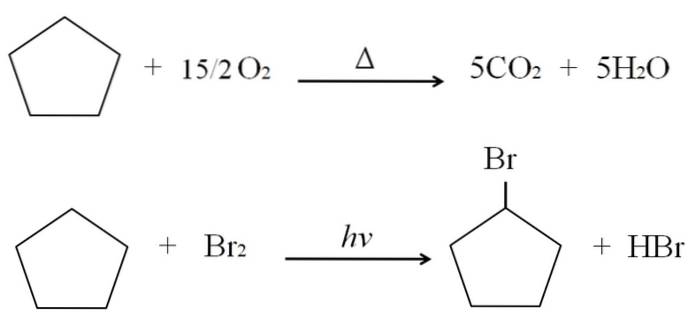
Reakcje spalania i chlorowcowania cyklopentanu przedstawiono na przykładzie powyżej. Jeden jego mol spala się pod wpływem ciepła, a 7,5 mola tlenu cząsteczkowego rozkłada się na COdwa i HdwaO. Z drugiej strony, w obecności promieniowania ultrafioletowego i bromu, zastępuje H zamiast Br, uwalniając gazową cząsteczkę HBr.
Aplikacje
Stosowanie cykloalkanów w dużym stopniu zależy od ich liczby atomów węgla. Najlżejsze, a zatem gazowe, były kiedyś używane do zasilania lamp gazowych oświetlenia publicznego.
Z kolei płyny mają zastosowanie jako rozpuszczalniki do olejów, tłuszczów lub produktów handlowych o charakterze niepolarnym. Wśród nich można wymienić cyklopentan, cykloheksan i cykloheptan. Podobnie, są one zwykle używane bardzo często w rutynowych operacjach w laboratoriach naftowych lub przy opracowywaniu paliw..
Jeśli są cięższe, można je stosować jako smary. Z drugiej strony mogą również stanowić materiał wyjściowy do syntezy leków; takie jak karboplatyna, która zawiera w swojej strukturze pierścień cyklobutanu.
Przykłady cykloalkanów
Na koniec wracamy do początku artykułu: obraz z kilkoma niepodstawionymi cykloalkanami.
Aby zapamiętać cykloalkany, wystarczy pomyśleć o figurach geometrycznych: trójkąt (cyklopropan), kwadrat (cyklobutan), pentagon (cyklopentan), heksagon (cykloheksan), heptagon (cykloheptan), dekagon (cyklodekan), pięciokąt (cyklopentadekan) i tak dalej..
Im większy pierścień, tym mniej przypomina jego odpowiednią figurę geometryczną. Widzieliśmy już, że cykloheksan nie jest sześciokątem; to samo jest bardziej widoczne w przypadku cyklotetradekanu (czternaście węgli).
Nadchodzi moment, w którym będą zachowywać się jak naszyjniki, które można złożyć, aby maksymalnie zredukować naprężenia ich ogniw i zaćmienia..
Bibliografia
- Morrison, R. T. and Boyd, R, N. (1987). Chemia organiczna. Wydanie 5. Od redakcji Addison-Wesley Interamericana.
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. Aminy. (Wydanie 10.). Wiley plus.
- Chemia LibreTexts. (02 czerwca 2019). Nazewnictwo cykloalkanów. Źródło: chem.libretexts.org
- Wikipedia. (2019). Cykloalkan. Odzyskane z: en.wikipedia.org
- Clark Jim. (2015). Wprowadzenie alkanów i cykloalkanów. Źródło: chemguide.co.uk
- James Ashenhurst. (2019). Konformacje i cykloalkany. Magister chemii organicznej. Odzyskane z: masterorganicchemistry.com
- Fernández Germán. (s.f.). Teoria cykloalkanów. Chemia organiczna. Odzyskane z: quimicaorganica.org



Jeszcze bez komentarzy