
Charakterystyka cykloalkin, zastosowania, przykłady
Plik cykloalkiny Są to związki organiczne, które mają jedno lub więcej wiązań potrójnych i jednostkę cykliczną. Jego skondensowane wzory cząsteczkowe są zgodne ze wzorem C.nH.2n-4. Zatem, jeśli n jest równe 3, wówczas wzór wspomnianej cykloalkiny będzie wyglądał na C3H.dwa.
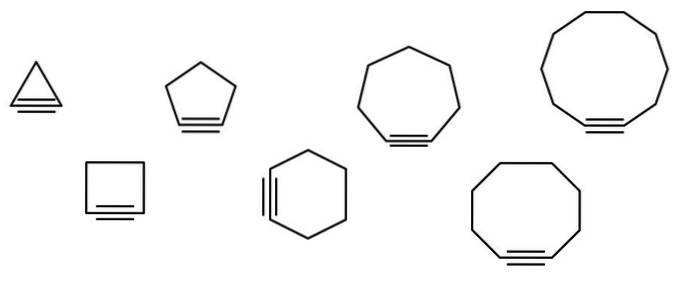
Na poniższym obrazku zilustrowano szereg figur geometrycznych, ale w rzeczywistości składają się one z przykładów cykloalkin. Każdy z nich można uznać za bardziej utlenioną wersję odpowiednich cykloalkanów (bez podwójnych lub potrójnych wiązań). Gdy brakuje im heteroatomu (O, N, S, F itd.), Są tylko „prostymi” węglowodorami..
Chemia wokół cykloalkin jest bardzo złożona, a mechanizmy ich reakcji są jeszcze bardziej złożone. Stanowią punkt wyjścia do syntezy wielu związków organicznych, które z kolei podlegają możliwym zastosowaniom.
Ogólnie rzecz biorąc, są one wysoce reaktywne, chyba że są „zniekształcone” lub skompleksowane z metalami przejściowymi. Podobnie, jego potrójne wiązania mogą być sprzężone z podwójnymi wiązaniami, tworząc cykliczne jednostki w cząsteczkach..
Jeśli tak nie jest, w swoich najprostszych strukturach są one zdolne do dodawania małych cząsteczek do swoich potrójnych wiązań..
Indeks artykułów
- 1 Charakterystyka cykloalkin
- 1.1 Niedostrzegalność i wiązanie potrójne
- 1.2 Siły międzycząsteczkowe
- 1.3 Naprężenie kątowe
- 2 Nazewnictwo
- 3 Aplikacje
- 4 Przykłady
- 5 Referencje
Charakterystyka cykloalkin
Apolarność i potrójne wiązanie
Cykloalkiny charakteryzują się tym, że są cząsteczkami apolarnymi, a zatem hydrofobowymi. Może się to zmienić, jeśli w swoich strukturach mają jakiś heteroatom lub grupę funkcyjną, która daje im znaczny moment dipolowy; jak to się dzieje w heterocyklach z potrójnymi wiązaniami.
Ale co to jest potrójne wiązanie? Są to nie więcej niż trzy równoczesne interakcje między dwoma atomami węgla z hybrydyzacją sp. Jedno wiązanie jest proste (σ), a pozostałe dwa π, prostopadłe do siebie. Oba atomy węgla mają wolny orbitalny splot do wiązania z innymi atomami (R-C≡C-R).
Te orbitale hybrydowe mają charakter 50% s i 50% p. Ponieważ orbitale s są bardziej penetrujące niż orbitale p, fakt ten sprawia, że dwa atomy węgla w wiązaniu potrójnym są bardziej kwaśne (akceptory elektronów) niż atomy węgla w alkanach lub alkenach..
Z tego powodu wiązanie potrójne (≡) stanowi specyficzny punkt, w którym gatunki donorów elektronów mogą się do niego przyłączać, tworząc wiązania pojedyncze..
Powoduje to zerwanie jednego z wiązań π, stając się wiązaniem podwójnym (C = C). Dodawanie trwa do R.4C-CR4, czyli w pełni nasycone węgle.
Powyższe można również wyjaśnić w ten sposób: potrójne wiązanie jest podwójnym nienasyceniem.
Siły międzycząsteczkowe
Cząsteczki cykloalkiny oddziałują poprzez siły rozpraszania lub siły Londynu oraz przez interakcje typu π-π. Te interakcje są słabe, ale wraz ze wzrostem rozmiaru cykli (podobnie jak ostatnie trzy po prawej stronie obrazu) udaje im się tworzyć ciała stałe w temperaturze pokojowej i pod ciśnieniem..
Naprężenie kątowe
Wiązania w wiązaniu potrójnym znajdują się na tej samej płaszczyźnie i linii. Dlatego -C≡C- ma geometrię liniową, z orbitali sp oddalonych o około 180º.
Ma to poważny wpływ na stereochemiczną stabilność cykloalkin. „Zginanie” orbitali sp wymaga dużo energii, ponieważ nie są one elastyczne.
Im mniejsza cykloalkina, tym bardziej orbitale sp muszą zginać się, aby umożliwić jej fizyczne istnienie. Analizując obraz, widać od lewej do prawej, że w trójkącie kąt wiązań z bokami wiązania potrójnego jest bardzo wyraźny; podczas gdy w dziesięciokącie są mniej strome.
Im większa cykloalkina, tym bliżej kąta wiązania orbitali sp zbliża się do idealnego 180º. Odwrotnie dzieje się, gdy są mniejsze, zmuszając je do zginania i tworzenia naprężenie kątowe w nich destabilizując cykloalkinę.
Tym samym większe cykloalkiny mają mniejsze naprężenia kątowe, co umożliwia ich syntezę i magazynowanie. Dzięki temu trójkąt jest najbardziej niestabilną cykloalkiną, a dziesięciokąt najbardziej stabilnym z nich wszystkich..
W rzeczywistości cyklooktyno (to z ośmiokątem) jest najmniejszym i najbardziej stabilnym znanym rozmiarem; inne istnieją tylko jako chwilowi pośrednicy w reakcjach chemicznych.
Nomenklatura
Do nazwania cykloalkin należy zastosować te same standardy IUPAC, jak dla cykloalkanów i cykloalkenów. Jedyna różnica polega na końcówce -ico na końcu nazwy związku organicznego..
Główny łańcuch to ten, który ma potrójne wiązanie i zaczyna być numerowany od najbliższego końca. Jeśli masz na przykład cyklopropan, to potrójne wiązanie będzie nazywane cyklopropino (trójkąt na obrazku). Jeśli grupa metylowa jest dołączona do górnego wierzchołka, to będzie to: 2-metylocyklopropino.
Węgle R-C≡C-R mają już cztery wiązania, więc brakuje mu wodorów (jak w przypadku wszystkich cykloalkin na obrazku). Dzieje się tak nie tylko wtedy, gdy wiązanie potrójne znajduje się w pozycji końcowej, to znaczy na końcu łańcucha (R-C≡C-H).
Aplikacje
Cykloalkiny nie są związkami bardzo popularnymi, więc nie są też ich zastosowania. Mogą służyć jako spoiwa (grupy koordynujące) z metalami przejściowymi, tworząc w ten sposób nieskończoną liczbę związków metaloorganicznych, które można wykorzystać do bardzo rygorystycznych i specyficznych zastosowań..
Na ogół są to rozpuszczalniki w najbardziej nasyconej i stabilnej postaci. Gdy składają się z heterocykli, oprócz wewnętrznych jednostek cyklicznych C≡C-C = C-C≡C, znajdują interesujące i obiecujące zastosowania jako leki przeciwnowotworowe; Tak jest w przypadku dinemycyny A. Zsyntetyzowano z niej inne związki o analogiach strukturalnych..
Przykłady
Obraz przedstawia siedem prostych cykloalkin, w których nie ma prawie jednego potrójnego wiązania. Od lewej do prawej, wraz z ich nazwami, znajdują się: cyclopropino, trójkąt; cyclobutino, plac; cyklopentyna, pięciokąt; cykloheksyna, sześciokąt; cykloheptyna, heptagon; cyclooctino, ośmiokąt; i cyclodecino, dekagon.
W oparciu o te struktury i podstawienie atomów wodoru w węglach nasyconych można otrzymać inne pochodne z nich związki. Mogą być również poddawane warunkom utleniania w celu wytworzenia podwójnych wiązań po innych stronach cykli..
Te jednostki geometryczne mogą być częścią większej struktury, zwiększając szanse na funkcjonalizację całego zbioru. Nie ma wielu dostępnych przykładów cykloalkin, przynajmniej nie bez zagłębienia się w głębokie sfery syntezy organicznej i farmakologii..
Bibliografia
- Francis A. Carey. Chemia organiczna. (Wydanie szóste, str. 372, 375). Mc Graw Hill.
- Wikipedia. (2018). Cykloalkin. Zaczerpnięte z: en.wikipedia.org
- William Reusch. (5 maja 2013). Nazewnictwo związków organicznych. Zaczerpnięte z: 2.chemistry.msu.edu
- Chemia nieorganiczna. Cykloalkiny. Zaczerpnięte z: fullquimica.com
- Patrizia Diana i Girolamo Cirrincione. (2015). Biosynteza heterocykli od izolacji do klastra genów. Wiley, strona 181.
- Ciekawa chemia organiczna i produkty naturalne. (17 kwietnia 2015). Cykloalkiny. Zaczerpnięte z: quintus.mickel.ch



Jeszcze bez komentarzy