
Struktura, właściwości, zastosowania i synteza cyklobutanu

Plik cyklobutan jest węglowodorem składającym się z czterowęglowego cykloalkanu, którego wzór cząsteczkowy to C4H.8. Można go również nazwać tetrametylenem, biorąc pod uwagę, że są to cztery jednostki CHdwa które tworzą pierścień o kwadratowej geometrii, chociaż nazwa cyklobutan jest bardziej akceptowana i znana.
W temperaturze pokojowej jest to bezbarwny, łatwopalny gaz, który pali się jasnym płomieniem. Jego najbardziej prymitywne zastosowanie to źródło ciepła podczas spalania; Jednak jej podstawa strukturalna (kwadrat) obejmuje głębokie aspekty biologiczne i chemiczne i współdziała w pewien sposób z właściwościami tych związków..
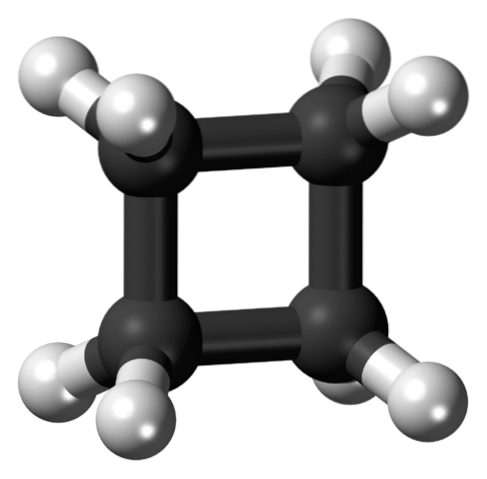
Górny obraz przedstawia cząsteczkę cyklobutanu o kwadratowej strukturze. W następnej sekcji wyjaśnimy, dlaczego ta konformacja jest niestabilna, ponieważ jej linki są napięte..
Po cyklopropanie jest to najbardziej niestabilny cykloalkan, ponieważ im mniejszy rozmiar pierścienia, tym bardziej będzie reaktywny. Zgodnie z tym cyklobutan jest bardziej niestabilny niż cykle pentanu i heksanu. Ciekawie jest jednak zobaczyć w jego pochodnych jądro lub kwadratowe serce, które, jak zobaczymy, jest dynamiczne.
Indeks artykułów
- 1 Struktura cyklobutanu
- 1.1 Konformacje motylkowe lub pomarszczone
- 1.2 Oddziaływania międzycząsteczkowe
- 2 Właściwości
- 2.1 Wygląd fizyczny
- 2.2 Masa cząsteczkowa
- 2.3 Temperatura wrzenia
- 2.4 Temperatura topnienia
- 2.5 Temperatura zapłonu
- 2.6 Rozpuszczalność
- 2.7 Gęstość
- 2.8 Gęstość par
- 2.9 Prężność par
- 2.10 Współczynnik załamania światła
- 2.11 Entalpia spalania
- 2.12 Ciepło formowania
- 3 Synteza
- 4 Zastosowania
- 5 Referencje
Struktura cyklobutanu
Na pierwszym zdjęciu struktura cyklobutanu została podana jako prosty zwęglony i uwodorniony kwadrat. Jednak w tym idealnym kwadracie orbitale ulegają silnemu skręceniu w stosunku do ich pierwotnych kątów: są oddzielone kątem 90º w porównaniu do 109,5º dla atomu węgla z hybrydyzacją sp.3 (naprężenie kątowe).
Atomy węgla sp3 są czworościenne i dla niektórych czworościanów byłoby trudno wygiąć ich orbitale do takiego stopnia, aby uzyskać kąt 90 °; ale byłoby jeszcze bardziej dla węgli z hybrydyzacjami spdwa (120º) i sp (180º) odbiegają od swoich pierwotnych kątów. Z tego powodu cyklobutan zawiera atomy węgla sp3 w istocie.
Ponadto atomy wodoru są bardzo blisko siebie, zaćmione w przestrzeni. Powoduje to wzrost zawady sterycznej, która osłabia domniemany kwadrat z powodu wysokiego naprężenia skrętnego..
Dlatego naprężenia kątowe i skręcające (zawarte w określeniu „naprężenie pierścieniowe”) powodują, że konformacja ta jest niestabilna w normalnych warunkach..
Cząsteczka cyklobutanu będzie dążyć do zmniejszenia obu naprężeń i aby to osiągnąć, przyjmuje tak zwaną konformację motylkową lub pofałdowaną..
Motyle lub pomarszczone konformacje
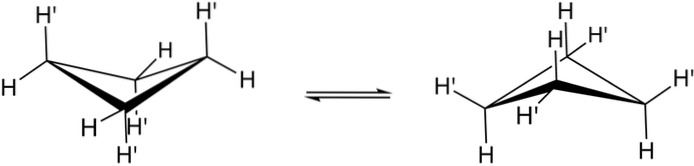
Prawdziwe konformacje cyklobutanu pokazano powyżej. W nich zmniejszają się naprężenia kątowe i skrętne; ponieważ, jak widać, obecnie nie wszystkie atomy wodoru są zaćmione. Istnieje jednak koszt energii: kąt jego ogniw jest zaostrzony, to znaczy spada z 90 do 88º.
Zauważ, że można go porównać do motyla, którego trójkątne skrzydła składają się z trzech atomów węgla; a czwarty pod kątem 25 ° w stosunku do każdego skrzydła. Strzałki dwukierunkowe wskazują, że istnieje równowaga między obydwoma konformerami. To tak, jakby motyl opadł i uniósł skrzydła.
Z drugiej strony, w pochodnych cyklobutanu należałoby oczekiwać, że to trzepotanie będzie znacznie wolniejsze i utrudnione przestrzennie..
Oddziaływania międzycząsteczkowe
Przypuśćmy, że na chwilę zapomnisz o kwadratach i zastąpią je gazowane motyle. Te w trzepotaniu mogą być utrzymywane razem w cieczy tylko przez siły dyspersyjne Londynu, które są proporcjonalne do powierzchni ich skrzydeł i ich masy cząsteczkowej..
Nieruchomości
Wygląd fizyczny
Bezbarwny gaz.
Masa cząsteczkowa
56,107 g / mol.
Temperatura wrzenia
12,6 ° C Dlatego też w niskich temperaturach można by się nim posługiwać w zasadzie jak z każdym płynem; z jedynym szczegółem, że byłby bardzo lotny, a jego opary nadal stanowiłyby ryzyko do wzięcia pod uwagę.
Temperatura topnienia
-91ºC.
punkt zapłonu
Szkło zamknięte o temperaturze 50ºC.
Rozpuszczalność
Nierozpuszczalny w wodzie, co nie jest zaskakujące, biorąc pod uwagę jego niepolarny charakter; ale jest słabo rozpuszczalny w alkoholach, eterze i acetonie, które są mniej polarnymi rozpuszczalnikami. Oczekuje się, że będzie rozpuszczalny (chociaż nie podano) logicznie w rozpuszczalnikach niepolarnych, takich jak czterochlorek węgla, benzen, ksylen itp..
Gęstość
0,7125 przy 5ºC (w stosunku do 1 wody).
Gęstość pary
1,93 (w stosunku do 1 powietrza). Oznacza to, że jest gęstszy od powietrza, a zatem, jeśli nie będzie prądów, jego tendencja nie będzie rosła..
Ciśnienie pary
1180 mmHg w 25ºC.
Współczynnik załamania światła
1,3625 w 290ºC.
Entalpia spalania
-655,9 kJ / mol.
Ciepło formowania
6,6 Kcal / mol w 25ºC.
Synteza
Cyklobutan jest syntetyzowany przez uwodornienie cyklobutadienu, którego struktura jest prawie taka sama, z tą różnicą, że ma podwójne wiązanie; i dlatego jest jeszcze bardziej reaktywny. Jest to chyba najprostsza droga syntezy do jej uzyskania, a przynajmniej tylko do niej, a nie do pochodnej.
W ropie naftowej jest mało prawdopodobne, ponieważ w końcu zareagowałby w taki sposób, że zerwałby pierścień i utworzył łańcuch liniowy, czyli n-butan.
Inną metodą otrzymywania cyklobutanu jest uderzanie promieniowania ultrafioletowego w cząsteczki etylenu, CHdwa= CHdwa, które dimeryzują. Ta reakcja jest faworyzowana fotochemicznie, ale nie termodynamicznie:
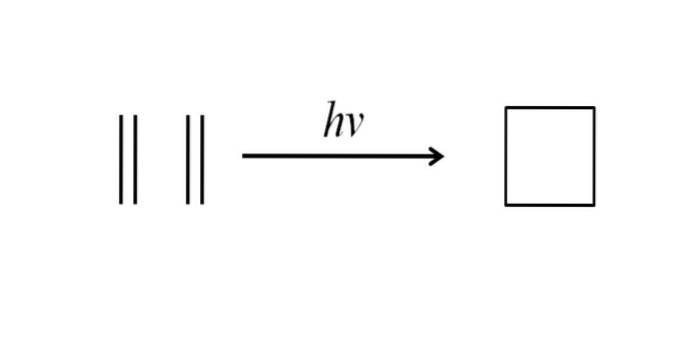
Powyższy obraz bardzo dobrze podsumowuje to, co zostało powiedziane w powyższym akapicie. Gdyby zamiast etylenu miałby się na przykład dowolne dwa alkeny, otrzymywałby się podstawiony cyklobutan; lub co jest tym samym, pochodną cyklobutanu. W rzeczywistości tą metodą zsyntetyzowano wiele pochodnych o interesujących strukturach..
Jednak inne pochodne obejmują szereg skomplikowanych etapów syntezy. Dlatego cyklobutany (jak nazywane są ich pochodne) są przedmiotem badań nad syntezami organicznymi..
Aplikacje
Sam cyklobutan nie ma innego zastosowania niż służyć jako źródło ciepła; ale jego pochodne wkraczają w skomplikowany teren w syntezie organicznej, znajdując zastosowanie w farmakologii, biotechnologii i medycynie. Bez zagłębiania się w zbyt złożone struktury, przykładami cyklobutanów są penitrems i grandisol.
Cyklobutany na ogół mają właściwości korzystne dla metabolizmu bakterii, roślin, bezkręgowców morskich i grzybów. Są biologicznie aktywne, dlatego ich zastosowania są bardzo zróżnicowane i trudne do określenia, ponieważ każde z nich ma swój szczególny wpływ na określone organizmy..
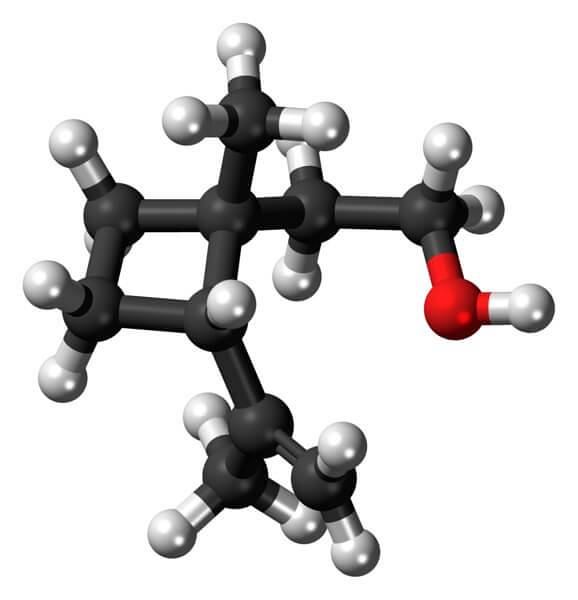
Na przykład Grandisol jest feromonem pochodzącym od wołka (rodzaj chrząszcza). Powyżej na koniec pokazano jego strukturę, uważaną za monoterpen o kwadratowej podstawie cyklobutanu.
Bibliografia
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- Graham Solomons, T.W.; Craig B. Fryhle. (2011). Chemia organiczna. (jedenaścieth wydanie). Wiley.
- Wikipedia. (2019). Cyklobutan. Odzyskane z: en.wikipedia.org
- PubChem. (2019). Cyklobutan. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Peiris Nicole. (29 listopada 2015). Właściwości fizyczne cykloalkanów. Chemia LibreTexts. Źródło: chem.libretexts.org
- Wiberg B. Kenneth. (2005). Właściwości fizyczne cyklobutanu i badania teoretyczne. Wydział Chemii Uniwersytetu Yale.
- Klement Foo. (s.f.). Cyklobutany w syntezie organicznej. Odzyskany z: scripps.edu
- Myers. (s.f.). Synteza cyklobutanów. Chem 115. Odzyskane z: hwpi.harvard.edu



Jeszcze bez komentarzy