
Struktura, właściwości, wytwarzanie, zastosowania kwasu benzoesowego
Plik kwas benzoesowy jest najprostszym kwasem aromatycznym o wzorze cząsteczkowym C6H.5COOH. Swoją nazwę zawdzięcza temu, że jego głównym źródłem była przez długi czas benzoes, żywicę pozyskiwaną z kory kilku drzew z rodzaju Styrax..
Występuje w wielu roślinach, zwłaszcza w owocach, takich jak morele i jagody. Jest również wytwarzany przez bakterie jako produkt uboczny metabolizmu aminokwasu fenyloalaniny. Jest również wytwarzany w jelicie w wyniku bakteryjnego (oksydacyjnego) przetwarzania polifenoli obecnych w niektórych pokarmach..

Jak widać na powyższym obrazku, C6H.5W przeciwieństwie do wielu kwasów COOH jest związkiem stałym. Jego ciało stałe składa się z lekkich, białych i nitkowatych kryształów, które wydzielają migdałowy aromat.
Igły te są znane od XVI wieku; na przykład Nostradamus w 1556 roku opisuje jego suchą destylację z gumy benzoinowej.
Jedną z głównych właściwości kwasu benzoesowego jest hamowanie wzrostu drożdży, pleśni i niektórych bakterii; w którym jest stosowany jako środek konserwujący żywność. To działanie zależy od pH.
Kwas benzoesowy ma kilka właściwości leczniczych, jest stosowany jako składnik produktów farmaceutycznych stosowanych w leczeniu chorób skóry, takich jak grzybica i grzybica stóp. Jest również stosowany jako wziewny środek zmniejszający przekrwienie, wykrztuśny i przeciwbólowy.
Duża część kwasu benzoesowego produkowanego przemysłowo jest przeznaczona do produkcji fenolu. Podobnie część przeznaczona jest do produkcji benzoesanów glikolu, wykorzystywanych do produkcji plastyfikatorów..
Chociaż kwas benzoesowy nie jest szczególnie toksycznym związkiem, ma pewne szkodliwe działanie na zdrowie. Z tego powodu WHO zaleca maksymalną dawkę 5 mg / kg masy ciała dziennie, co odpowiada dziennemu spożyciu 300 mg kwasu benzoesowego..
Indeks artykułów
- 1 Struktura kwasu benzoesowego
- 1.1 Wiązania kryształowe i wodorowe
- 2 Właściwości fizyczne i chemiczne
- 2.1 Nazwy chemiczne
- 2.2 Wzór cząsteczkowy
- 2.3 Masa cząsteczkowa
- 2.4 Opis fizyczny
- 2.5 Zapach
- 2.6 Smak
- 2.7 Temperatura wrzenia
- 2.8 Temperatura topnienia
- 2.9 Temperatura zapłonu
- 2.10 Sublimacja
- 2.11 Rozpuszczalność w wodzie
- 2.12 Rozpuszczalność w rozpuszczalnikach organicznych
- 2.13 Gęstość
- 2.14 Gęstość par
- 2.15 Prężność par
- 2.16 Stabilność
- 2.17 Rozkład
- 2.18 Lepkość
- 2.19 Ciepło spalania
- 2.20 Ciepło parowania
- 2,21 pH
- 2.22 Napięcie powierzchniowe
- 2,23 pKa
- 2.24 Współczynnik załamania światła
- 2.25 Reakcje
- 3 Produkcja
- 4 Zastosowania
- 4.1 Przemysłowe
- 4.2 Leczniczy
- 4.3 Konserwacja żywności
- 4.4 Inne
- 5 Toksyczność
- 6 Odnośniki
Struktura kwasu benzoesowego
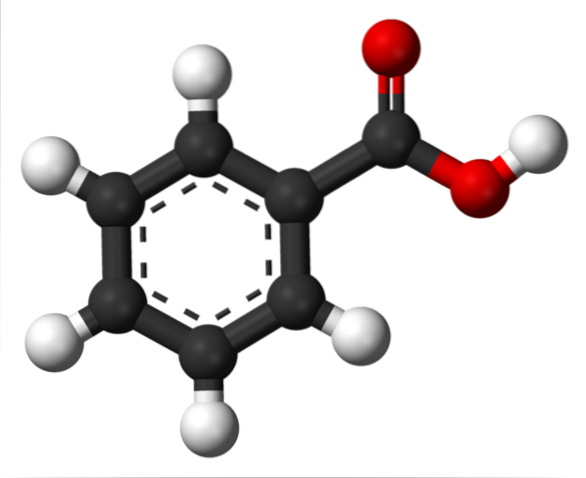
Na górnym obrazku strukturę kwasu benzoesowego przedstawiono za pomocą modelu prętów i kulek. Jeśli policzy się liczbę czarnych kulek, zostanie sprawdzone, że jest ich sześć, to znaczy sześć atomów węgla; dwie czerwone kule odpowiadają dwóm atomom tlenu grupy karboksylowej -COOH; i wreszcie, białe kule to atomy wodoru.
Jak widać, po lewej stronie znajduje się pierścień aromatyczny, którego aromatyczność ilustrują linie przerywane w środku pierścienia. A po prawej grupa -COOH, odpowiedzialna za kwasowe właściwości tego związku.
Molekularnie C6H.5COOH ma płaską strukturę, ponieważ wszystkie jego atomy (z wyjątkiem wodorów) mają hybrydyzację spdwa.
Z drugiej strony silnie polarna grupa -COOH umożliwia istnienie w strukturze trwałego dipola; dipol, który można by zobaczyć na pierwszy rzut oka, gdyby była dostępna jego mapa potencjału elektrostatycznego.
Fakt ten powoduje, że C6H.5COOH może oddziaływać ze sobą poprzez siły dipolowo-dipolowe; w szczególności ze specjalnymi wiązaniami wodorowymi.
Jeśli spojrzysz na grupę -COOH, zobaczysz, że tlen w C = O może akceptować wiązanie wodorowe; podczas gdy tlen z O-H przekazuje je.
Wiązania kryształowe i wodorowe
Kwas benzoesowy może tworzyć dwa wiązania wodorowe: jedno otrzymuje i przyjmuje jedno. Dlatego tworzy dimery; to znaczy, że jego cząsteczka jest „spokrewniona” z inną.
Czy to pary czy dimery, C6H.5COOH-HOOCC6H.5, podstawa konstrukcyjna definiująca bryłę wynikającą z jej rozmieszczenia w przestrzeni.
Te dimery tworzą płaszczyznę cząsteczek, które, biorąc pod uwagę ich silne i kierunkowe interakcje, potrafią ustanowić uporządkowany wzór w ciele stałym. Pierścienie aromatyczne również uczestniczą w tym porządkowaniu poprzez interakcje sił rozpraszania..
W rezultacie cząsteczki tworzą kryształ jednoskośny, którego dokładne cechy strukturalne można badać za pomocą technik instrumentalnych, takich jak dyfrakcja rentgenowska..
To stąd para płaskich cząsteczek może zostać ułożona w przestrzeni, głównie przez wiązania wodorowe, aby dać początek tym białym i krystalicznym igłom..
Fizyczne i chemiczne właściwości
Nazwy chemiczne
Kwas:
-benzoesowy
-benzen karboksylowy
-dracyliczny
-karboksybenzen
-benzenoform
Formuła molekularna
do7H.6LUBdwa lub C6H.5COOH.
Waga molekularna
122,123 g / mol.
Opis fizyczny
Ciało stałe lub w postaci kryształów, zwykle w kolorze białym, ale może być koloru beżowego, jeśli zawiera pewne zanieczyszczenia. Jego kryształy są łuszczące się lub w kształcie igieł (patrz pierwsze zdjęcie).
Zapach
Pachnie migdałami i jest przyjemny.
Smak
Bez smaku lub lekko gorzkie. Granica wykrywalności aromatu wynosi 85 ppm.
Temperatura wrzenia
480ºF do 760 mmHg (249ºC).
Temperatura topnienia
252,3 ° F (121,5 - 123,5 ° C).
punkt zapłonu
250ºF (121ºC).
Sublimacja
Może sublimować już od 100 ºC.
Rozpuszczalność w wodzie
3,4 g / L przy 25 ºC.
Rozpuszczalność w rozpuszczalnikach organicznych
-1 g kwasu benzoesowego rozpuszcza się w objętości równej: 2,3 ml zimnego alkoholu; 4,5 ml chloroformu; 3 ml eteru; 3 ml acetonu; 30 ml czterochlorku węgla; 10 ml benzenu; 30 ml disiarczku węgla; i 2,3 ml terpentyny.
-Jest również rozpuszczalny w olejach lotnych i nielotnych.
-Jest słabo rozpuszczalny w eterze naftowym.
-Jego rozpuszczalność w heksanie wynosi 0,9 g / l, w metanolu 71,5 g / l, a w toluenie 10,6 g / l.
Gęstość
1,316 g / ml w 82,4 ° F i 1,2659 g / ml w 15 ° C.
Gęstość pary
4,21 (w stosunku do powietrza przyjętego jako odniesienie = 1)
Ciśnienie pary
1 mmHg przy 205ºF i 7,0 x 10-4 mmHg przy 25 ºC.
Stabilność
Roztwór o stężeniu 0,1% w wodzie jest stabilny przez co najmniej 8 tygodni.
Rozkład
Rozkłada się podczas ogrzewania, wydzielając gryzący i drażniący dym.
Lepkość
1,26 cPoise w 130 ºC.
Ciepło spalania
3227 KJ / mol.
Ciepło parowania
534 KJ / mol w 249 ºC.
pH
Około 4 w wodzie.
Napięcie powierzchniowe
31 N / m przy 130 ºC.
pKa
4,19 w 25 ° C.
Współczynnik załamania światła
1,504 - 1,5397 (ηD) przy 20 ºC.
Reakcje
-W kontakcie z zasadami (NaOH, KOH itp.) Tworzy sole benzoesanowe. Na przykład, jeśli reaguje z NaOH, tworzy benzoesan sodu, C6H.5COONa.
-Reaguje z alkoholami tworząc estry. Na przykład jego reakcja z alkoholem etylowym prowadzi do powstania estru etylowego. Niektóre estry kwasu benzoesowego służą jako plastyfikatory.
-Reaguje z pięciochlorkiem fosforu, PCl5, tworząc chlorek benzoilu, halogenek kwasowy. Chlorek benzoilu może reagować z amonem (NH3) lub aminy, takiej jak metyloamina (CH3NHdwa) tworząc benzamid.
-Reakcja kwasu benzoesowego z kwasem siarkowym powoduje sulfonowanie pierścienia aromatycznego. Grupa funkcjonalna -SO3H zastępuje atom wodoru w pozycji meta pierścienia.
-Może reagować z kwasem azotowym, wykorzystując jako katalizator kwas siarkowy, tworząc kwas meta-nitrobenzoesowy.
-W obecności katalizatora, takiego jak chlorek żelazowy, FeCl3, kwas benzoesowy reaguje z halogenami; na przykład reaguje z chlorem, tworząc kwas meta-chlorobenzoesowy.
Produkcja
Poniżej wymieniono niektóre metody produkcji tego związku:
-Większość kwasu benzoesowego jest produkowana przemysłowo przez utlenianie toluenu tlenem z powietrza. Proces katalizowany jest naftenianem kobaltu w temperaturze 140-160 ºC i pod ciśnieniem 0,2 - 0,3 MPa.
-Z drugiej strony toluen można chlorować w celu wytworzenia benzotrichlorku, który jest następnie hydrolizowany do kwasu benzoesowego..
-Hydroliza benzonitrylu i benzamidu w środowisku kwaśnym lub zasadowym może prowadzić do powstania kwasu benzoesowego i jego sprzężonych zasad..
-Alkohol benzylowy w wyniku utleniania za pośrednictwem nadmanganianu potasu w środowisku wodnym wytwarza kwas benzoesowy. Reakcja zachodzi przez ogrzewanie lub destylację pod chłodnicą zwrotną. Po zakończeniu procesu mieszanina jest filtrowana w celu usunięcia dwutlenku manganu, a supernatant jest schładzany w celu uzyskania kwasu benzoesowego..
-Związek benzotrichlorku poddaje się reakcji z wodorotlenkiem wapnia, stosując sole żelaza lub żelaza jako katalizatory, początkowo tworząc benzoesan wapnia, Ca (C6H.5GRUCHAĆ)dwa. Następnie ta sól w reakcji z kwasem solnym przekształca się w kwas benzoesowy.
Aplikacje
Przemysłowy
-Wykorzystywany jest do produkcji fenolu poprzez oksydacyjną dekarboksylację kwasu benzoesowego w temperaturach 300-400 ° C. W jakim celu? Ponieważ fenol można wykorzystać w syntezie nylonu.
-Z niego powstaje benzoesan glikolu, chemiczny prekursor estru glikolu dietylenowego i estru glikolu trietylenowego, substancji stosowanych jako plastyfikatory. Być może najważniejszym zastosowaniem plastyfikatorów są preparaty klejące. Niektóre estry o długim łańcuchu są używane do zmiękczania tworzyw sztucznych, takich jak PVC.
-Stosowany jest jako aktywator polimeryzacji gumy. Ponadto jest półproduktem do produkcji żywic alkidowych, a także dodatkami do zastosowań w odzysku ropy naftowej..
-Ponadto znajduje zastosowanie przy produkcji żywic, barwników, włókien, pestycydów oraz jako modyfikator żywicy poliamidowej do produkcji poliestru. Służy do utrzymania aromatu tytoniu.
-Jest prekursorem chlorku benzoilu, który jest materiałem wyjściowym do syntezy takich związków, jak benzoesan benzylu, wykorzystywanych do produkcji sztucznych aromatów i środków odstraszających owady..
Leczniczy
-Jest składnikiem maści Whitfielda, która jest stosowana w leczeniu grzybic skóry, takich jak grzybica i stopa atlety. Maść Whitfielda składa się z 6% kwasu benzoesowego i 3% kwasu salicylowego..
-Jest składnikiem nalewki benzoesowej, która była stosowana jako miejscowy środek antyseptyczny i wziewny środek zmniejszający przekrwienie. Kwas benzoesowy był stosowany do początku XX wieku jako środek wykrztuśny, przeciwbólowy i antyseptyczny.
-Kwas benzoesowy był stosowany w eksperymentalnej terapii pacjentów z chorobami związanymi z akumulacją resztkowego azotu.
Konserwacja żywności
Kwas benzoesowy i jego sole są używane do konserwowania żywności. Związek jest zdolny do hamowania wzrostu pleśni, drożdży i bakterii poprzez mechanizm zależny od pH..
Działają na te organizmy, gdy ich wewnątrzkomórkowe pH spada do pH poniżej 5, prawie całkowicie hamując beztlenową fermentację glukozy do produkcji kwasu benzoesowego. To działanie przeciwbakteryjne wymaga pH od 2,5 do 4 dla bardziej skutecznego działania..
-Służy do konserwowania żywności, takiej jak soki owocowe, napoje gazowane, napoje gazowane z kwasem fosforowym, pikle i inne zakwaszone potrawy.
Wada
Może reagować z kwasem askorbinowym (witaminą C) obecnym w niektórych napojach, wytwarzając benzen, związek rakotwórczy. Z tego powodu szukamy innych związków, które mają zdolność konserwowania żywności, które nie mają problemów z kwasem benzoesowym..
Inni
-Znajduje zastosowanie w opakowaniach aktywnych, występuje w foliach jonomerowych. Uwalnia się z nich kwas benzoesowy, który może hamować wzrost gatunków z rodzaju Penicillium i Aspergillus w pożywkach drobnoustrojów..
-Jest stosowany jako środek konserwujący aromat soków owocowych i perfum. Jest również używany w tym zastosowaniu w tytoniu.
-Kwas benzoesowy jest stosowany jako selektywny herbicyd do zwalczania chwastów szerokolistnych i traw w soi, ogórkach, melonach, orzeszkach ziemnych i drzewach ozdobnych..
Toksyczność
-W kontakcie ze skórą i oczami może powodować zaczerwienienie. Wdychanie może powodować podrażnienie dróg oddechowych i kaszel. Spożycie dużych ilości kwasu benzoesowego może powodować zaburzenia żołądkowo-jelitowe, które mogą prowadzić do uszkodzenia wątroby i nerek.
-Kwas benzoesowy i benzoesany mogą uwalniać histaminę, która może powodować reakcje alergiczne i podrażnienie oczu, skóry i błon śluzowych..
-Nie ma działania kumulacyjnego, mutagennego ani rakotwórczego, ponieważ jest szybko wchłaniany w jelicie, a wydalany z moczem bez gromadzenia się w organizmie..
-Maksymalna dopuszczalna dawka według WHO to 5 mg / kg masy ciała / dzień, około 300 mg / dzień. Dawka toksyczności ostrej u człowieka: 500 mg / kg.
Bibliografia
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. Aminy. (10th wydanie.). Wiley plus.
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- Książka chemiczna. (2017). Kwas benzoesowy. Odzyskane z: chemicalbook.com
- PubChem. (2018). Kwas benzoesowy. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Kwas benzoesowy. Odzyskane z: en.wikipedia.org
- Dadachanji, Dinshaw. (18 maja 2018). Właściwości chemiczne kwasu benzoesowego. Nauka. Odzyskany z: sciencing.com
- Ministerstwo Pracy i Spraw Socjalnych Hiszpanii. (s.f.). Kwas benzoesowy [PDF]. Międzynarodowe karty bezpieczeństwa chemicznego. Odzyskany z: insht.es


Jeszcze bez komentarzy