
Struktura wodorotlenku sodu (NaOH), właściwości, zastosowania, synteza

Plik wodorotlenek sodu Jest to związek nieorganiczny, którego wzór chemiczny to NaOH i składa się z bardzo mocnej zasady metalicznej lub zasady. 5% roztwór w wodzie ma pH zbliżone do 14.
Jest to bardzo higroskopijne białe ciało stałe, które może również pochłaniać dwutlenek węgla z powietrza, tworząc węglan sodu. Jest dostępny w handlu w plastikowych butelkach jako pigułki, których nie można wystawiać zbyt długo na powietrze ani nie należy nimi manipulować za pomocą szpatułek.

Wodorotlenek sodu można syntetyzować w reakcji wodorotlenku wapnia z węglanem sodu. Obecnie jednak jest zasadniczo syntetyzowany przez elektrolizę solanki i jest produktem ubocznym produkcji chloru gazowego..
Ze względu na wysoką zasadowość NaOH ma wiele zastosowań i zastosowań, takich jak produkcja papieru, mydeł, detergentów, barwników itp. Jest również stosowany w czyszczeniu gospodarstw domowych, uzdatnianiu wody, obróbce aluminium, produkcji leków itp.; a przede wszystkim jest to wzór drugorzędny par excellence.
Wodorotlenek sodu jest silnie żrący, może powodować podrażnienia i oparzenia skóry i oczu. Wdychając jego pył, może powodować obrzęk płuc. Tymczasem jego spożycie może spowodować tak poważne uszkodzenie przewodu pokarmowego, że może doprowadzić do śmierci..
Indeks artykułów
- 1 Struktura
- 1.1 Bezwodny
- 1.2 Nawilża
- 2 Właściwości fizyczne i chemiczne
- 2.1 Nazwy
- 2.2 Masa molowa
- 2.3 Wygląd
- 2.4 Temperatura topnienia
- 2.5 Temperatura wrzenia
- 2.6 Rozpuszczalność w wodzie
- 2,7 Podstawowość (pKb)
- 2,8 pH
- 2.9 Współczynnik załamania światła (nD)
- 2.10 Stabilność
- 2.11 Rozkład
- 2.12 Punkt samozapłonu
- 2.13 Lepkość
- 2.14 Ciepło parowania
- 2.15 Napięcie powierzchniowe
- 2.16 Reaktywność
- 3 Synteza
- 3.1 Reakcja węglanu sodu i wodorotlenku wapnia
- 3.2 Elektroliza chlorku sodu
- 4 Zastosowania
- 4.1 Środki czyszczące
- 4.2 Produkty farmaceutyczne i lecznicze
- 4.3 Procesy energetyczne
- 4.4 Uzdatnianie wody
- 4.5 Produkcja papieru
- 4.6 Produkcja przemysłowa
- 5 Ryzyka
- 6 Odnośniki
Struktura
Bezwodny

Górny obraz przedstawia jony tworzące NaOH. Kation Na+ jest reprezentowana przez fioletową kulę, podczas gdy anion hydroksylowy (wodorotlenek lub hydroksyl) OH- przez czerwono-białą kulę. Oba jony Na+ i OH- oddziałują ze sobą poprzez przyciąganie elektrostatyczne ich przeciwnych ładunków.
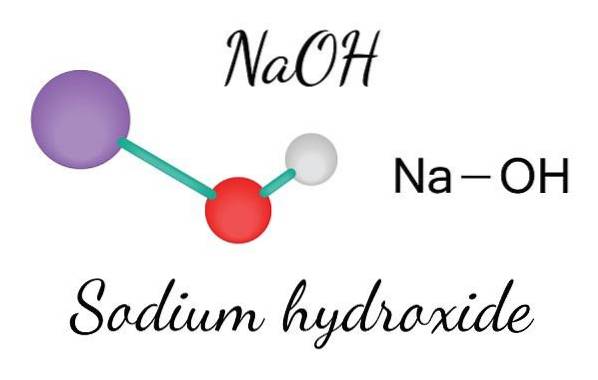
Takie interakcje są bezkierunkowe, więc przyciąganie pary jonowej Na+O- może wpływać na inne osoby znajdujące się w pewnej odległości. W rezultacie jony Na+ odpychajcie się nawzajem w taki sam sposób, jak OH-, aż do zdefiniowania kryształu o minimalnej energii, gdzie ustalą uporządkowaną i okresową strukturę (krystaliczny).
Dlatego pojawiają się rombowe kryształy bezwodnego NaOH (bez wody):
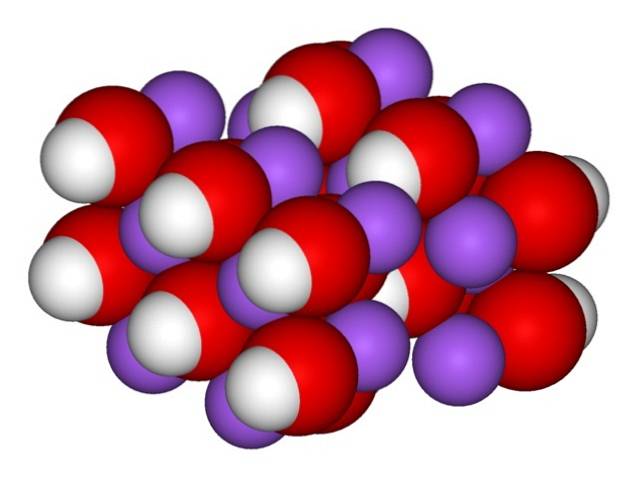
Jony pozostają wystarczająco spójne, aby bezwodny kryształ NaOH topił się w temperaturze 323 ºC (o ile w środowisku nie ma wilgoci).
Nawilża
Zarówno Na+ jak OH- Są to jony, które cząsteczki wody łatwo solwatują (hydratują). To sprzyja jego nawodnieniu powyżej energii siatkowej kryształów, dlatego NaOH uwalnia dużo energii, gdy wchodzi w kontakt z wodą..
Jednak bezwodne kryształy mogą zawierać nierozpuszczone cząsteczki wody; to znaczy wodorotlenek sodu może tworzyć liczne hydraty, NaOH nHdwaO. Cząsteczka wody może również tworzyć wiązanie wodorowe z OH- (HOH-OH-) lub skoordynować z Na+ (Na+-Odwa).
W zależności od stosunku molowego między NaOH i H.dwaLub monohydraty (NaOHHdwaO), dihydraty (NaOH 2HdwaO), trihemidraty (NaOH 3,5HdwaO), tetrahydraty (NaOH 4HdwaO), heptahydraty (NaOH 7HdwaO) i nie tylko.
Każdy z tych hydratów może krystalizować z wodnego roztworu NaOH o różnych procentach masowych i w różnych temperaturach. W konsekwencji NaOH wykazuje skomplikowany diagram rozpuszczalności w wodzie..
Ogólnie rzecz biorąc, kryształy hydratów są mniej gęste i mają niższe temperatury topnienia. Dzieje się tak, ponieważ cząsteczki wody „utrudniają” interakcje między Na+ i OH-, dodanie sił dipolowo-dipolowych przy poświęceniu przyciągania jonowego.
Fizyczne i chemiczne właściwości
Nazwy
Preferowana nazwa IUPAC: wodorotlenek sodu. Inne nazwy: Soda kaustyczna, Ascarite (rzadziej)
Masa cząsteczkowa
39,9971 g / mol
Wygląd
Białe, surowicze lub nieprzezroczyste ciało stałe lub kryształy.
Temperatura topnienia
323 ºC
Temperatura wrzenia
1388 ° C
Rozpuszczalność w wodzie
1000 g / L w temperaturze 25 ° C To pokazuje, jak bardzo może rozpuścić się w wodzie..
Ich wodne roztwory są lepkie, mają lepkość około osiemdziesięciu razy większą niż woda i na początku wydzielają dużo ciepła. Jeśli masz z nimi kontakt, czynią skórę śliską z powodu zmydlenia kwasów tłuszczowych w skórze..
Podstawowość (pKb)
- 0.56
pH
5% w / w roztwór wodny ma pH bliskie 14
Współczynnik załamania (nD)
Przy długości fali 580,4 nm: 1433 przy 320 ° C i 1421 przy 420 ° C.
Stabilność
Pojemniki zawierające go muszą być hermetycznie zamknięte, aby zapobiec tworzeniu się węglanu sodu. Wynika to z jego wysokiej higroskopijności, która powoduje, że pochłania wilgoć z otoczenia i zawartość CO.dwa.
Rozkład
Po podgrzaniu w celu rozkładu wydziela dym tlenku sodu.
Punkt samozapłonu
Nie jest łatwopalny
Lepkość
4,0 cPoise przy 350 ºC
Ciepło parowania
175 kJ / mol w temperaturze 1388 ° C
Napięcie powierzchniowe
74,35 dyn / cm w 2,72% w / w roztworze w wodzie o temperaturze 18 ° C.
Reaktywność
Z kwasami
Reaguje z organicznymi i nieorganicznymi kwasami mineralnymi, tworząc wodę i odpowiednią sól. W przypadku kwasu siarkowego reakcja jest egzotermiczna.
2 NaOH + Hdwapołudniowy zachód4 => Nadwapołudniowy zachód4 + 2 godzdwaLUB
Z tlenkami kwasowymi
Reaguje na przykład z dwutlenkiem siarki, dając siarczynową sól i wodę:
2 NaOH + SOdwa => Nadwapołudniowy zachód3 + H.dwaLUB
Z metalami
Jego wodne roztwory reagują z niektórymi metalami, tworząc złożone sole sodowe. Na przykład jego reakcja z cynkiem prowadzi do powstania cynku sodu:
Zn + 2 NaOH + 2 H.dwaO => Nadwa[Zn (OH)4] + Hdwa
Synteza
Wodorotlenek sodu jest syntetyzowany głównie dwoma metodami: przy użyciu początkowo stosowanego węglanu sodu oraz elektrolizy chlorku sodu, obecnie w większym zastosowaniu przemysłowym..
Reakcja węglanu sodu i wodorotlenku wapnia
Węglan sodu reaguje z wodorotlenkiem wapnia w procesie znanym jako kaustyzacja:
Ca (OH)dwa + NadwaWSPÓŁ3 => CaCO3 + NaOH
Węglan wapnia wytrąca się, pozostawiając wodorotlenek sodu w supernatancie, który jest zatężany przez odparowanie.
Węglan sodu pochodzi wcześniej z procesu Solvaya:
2 NaCl + CaCO3 => NadwaWSPÓŁ3 + CaCldwa
Elektroliza chlorku sodu
W wyniku elektrolizy chlorku sodu obecnego w solance powstaje gazowy wodór, chlorek i wodorotlenek sodu w roztworze wodnym:
2 Nacl + 2 HdwaO => H.dwa + Cldwa + 2 NaOH
Komora elektrolityczna składa się z komory, w której znajduje się anoda (+), wykonanej z tytanu oraz miejsca, w którym umieszczona jest solanka. Przedział ten jest oddzielony od przedziału katodowego (-) porowatą membraną..
Na anodzie zachodzi następująca reakcja:
2 Cl- => Cldwa + 2 e- (utlenianie)
Tymczasem ta reakcja zachodzi na katodzie:
2 godzdwaO + 2 e- => H.dwa + O- (zmniejszenie)
Sód (Na+) dyfunduje z przedziału anodowego do przedziału katodowego przez membranę, która je oddziela, tworząc wodorotlenek sodu.
Aplikacje
Produkty czyszczące
Wodorotlenek sodu jest używany do produkcji mydeł i detergentów używanych w domu i biznesie. Połączenie wodorotlenku sodu i chloru daje wybielacz chlorowy, używany do prania białej odzieży.
Eliminuje również gromadzenie się tłuszczu w drenach, powodując jego eliminację poprzez przekształcenie go w mydła w procesie zmydlania. Pozwala to na wyeliminowanie zatykania się rur w mieszkaniach i innych budynkach.
Produkty farmaceutyczne i lecznicze
Wodorotlenek sodu jest używany do wytwarzania popularnych środków przeciwbólowych, takich jak aspiryna. Również leków o działaniu przeciwzakrzepowym, które blokują tworzenie się skrzepów krwi oraz leków zmniejszających hipercholesterolemię.
Procesy energetyczne
Wodorotlenek sodu jest używany do produkcji ogniw paliwowych, które działają jak baterie, wytwarzając energię elektryczną do różnych zastosowań, w tym do transportu. Żywice epoksydowe wytwarzane z udziałem wodorotlenku sodu są stosowane w turbinach wiatrowych.
Uzdatnianie wody
Wodorotlenek sodu służy do neutralizacji kwasowości wody i przyczynia się do usuwania z niej metali ciężkich. Służy również do produkcji podchlorynu sodu, środka dezynfekującego wodę.
Wodorotlenek sodu reaguje z siarczanem glinu, tworząc wodorotlenek glinu: flokulant stosowany w oczyszczalniach wody w celu zwiększenia sedymentacji cząstek, powodując ich klarowanie..
Produkcja papieru
Wodorotlenek sodu jest stosowany wraz z siarczkiem sodu w obróbce drewna w celu uzyskania celulozy w niemal czystej postaci, która stanowi podstawę papieru. Jest również używany w recyklingu papieru, ponieważ pomagając w oddzielaniu atramentu, umożliwia jego ponowne użycie.
Produkcji przemysłowej
Wodorotlenek sodu jest używany do produkcji sztucznego jedwabiu, spandeksu, materiałów wybuchowych, żywic epoksydowych, szkła i ceramiki. Jest używany w przemyśle tekstylnym do produkcji barwników i przetwarzania tkanin bawełnianych.
W zakładach przeróbki trzciny cukrowej niskotemperaturowy wodorotlenek sodu jest używany do produkcji etanolu z wytłoków trzciny cukrowej.
Ryzyka
Wodorotlenek sodu jest związkiem silnie żrącym, więc może powodować oparzenia, pęcherze, a nawet trwałe blizny w kontakcie ze skórą.
W kontakcie z oczami może powodować poważne oparzenia, obrzęk, ból, niewyraźne widzenie, aw ciężkich przypadkach może spowodować trwałą ślepotę..
Połknięcie wodorotlenku sodu może spowodować oparzenia ust, języka, gardła, przełyku i żołądka. Typowe objawy to nudności, wymioty, skurcze żołądka i biegunka..
Chociaż wdychanie wodorotlenku sodu jest rzadkie i może wystąpić tylko z powodu obecności pyłu związku w powietrzu lub tworzenia się mgły, która go zawiera, powoduje podrażnienie płuc..
W przypadku długotrwałego narażenia może to spowodować obrzęk płuc i ostrą duszność, co stanowi stan nagły..
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Wikipedia. (2019). Wodorotlenek sodu. Odzyskane z: en.wikipedia.org
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Wodorotlenek sodu. Baza danych PubChem. CID = 14798. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Elementy amerykańskie. (2019). Roztwór wodorotlenku sodu. Odzyskany z: americanelements.com
- Fakty dotyczące bezpieczeństwa chemicznego. (2019). Wodorotlenek sodu. Odzyskany z: chemicalafetyfacts.org
- NJ Health. (2015). Wodorotlenek sodu. [PDF]. Odzyskany z: nj.gov
- Kanadyjskie Centrum Bezpieczeństwa i Higieny Pracy. (2019). Arkusze informacyjne z odpowiedziami dotyczącymi BHP: wodorotlenek sodu. Odzyskany z: ccohs.ca
- Ausetute. (s.f.). Produkcja wodorotlenku sodu i chloru metodą elektrolizy. Odzyskany z: ausetute.com.au



Jeszcze bez komentarzy