
Formuła kwasu chlorawego (HClO2), właściwości i zastosowanie

Plik kwas chlorawy jest związkiem nieorganicznym o wzorze HClOdwa. Wspomniany kwas jest jednym z oksydokwasów chloru, na którym znajduje się na stopniu utlenienia 3+. Chociaż kwas jest trudny do uzyskania w czystej postaci, koniugat zasady pochodzącej z tych kwasów, jon chlorynowy, jest stabilny..
Przykładem soli tego anionu jest dobrze znany chloryn sodu. Ta i pokrewne sole są czasami wykorzystywane do produkcji dwutlenku chloru..
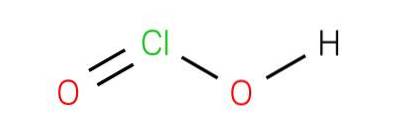
Kwas chlorawy to słaby kwas. Czysta substancja jest niestabilna, nieproporcjonalna do kwasu podchlorawego (stopień utlenienia Cl +1) i kwasu chlorowego (stopień utlenienia Cl +5):
2HClOdwa → HClO + HClO3
Kwas chlorawy otrzymuje się wraz z kwasem chlorowym w wyniku rozkładu wodnego roztworu ditlenku chloru.
Roztwór kwasu chlorawego otrzymano po raz pierwszy poprzez redukcję kwasu chlorowego kwasem winowym (A. J. Downs, 1973), jednak głównym sposobem otrzymywania tego kwasu jest traktowanie zawiesiny chlorku baru kwasem siarkowym:
Ba (ClOdwa)dwa + H.dwapołudniowy zachód4 → BaSO4 + 2HClOdwa
Kwas chlorawy jest silnym utleniaczem, chociaż jego tendencja do dysproporcji lub dysproporcji przeciwdziała jego potencjałowi utleniającemu..
Chlor jest jedynym halogenem, który tworzy możliwy do wyodrębnienia kwas o wzorze HXOdwa. Nie wyodrębniono ani kwasu bromowego, ani jodowego. Niektóre sole kwasu bromawego, bromity, są znane, ale oprócz związków pośrednich w reakcjach nie ma soli jodowych..
Indeks artykułów
- 1 Właściwości fizyczne i chemiczne
- 2 Reaktywność i zagrożenia
- 3 Zastosowania
- 4 Odnośniki
Fizyczne i chemiczne właściwości
Wyodrębniony kwas chlorawy jest bezbarwną cieczą bez charakterystycznego aromatu (National Center for Biotechnology Information, 2017).
Związek ma masę cząsteczkową 68,456 g / mol. Ma temperaturę wrzenia (obliczoną) 502,07 ° C i rozpuszczalność w wodzie (obliczoną) 1 × 106 mg / l (Royal Society of Chemistry, 2015).
HClOdwa jest niestabilny ze względu na reakcję dysmutacji (lub dysproporcjonowania) w celu wytworzenia kwasu chlorowego i podchlorawego (C. C. Hong, 1968), podobnie jak w przypadku analogów kwasów bromu i jodu:
2HClOdwa → HClO + HClO3
Kwas chlorawy jest uważany za słaby kwas, chociaż jego stała dysocjacji jest rzędu 1 x 10-dwa co nie czyni go tak słabym, jak inne kwasy o pKa 1,96.
Reaktywność i zagrożenia
Kwas chlorawy jest związkiem nietrwałym i silnym utleniaczem niekompatybilnym ze środkami redukującymi i zasadami..
Kwas chlorowy działa drażniąco w przypadku kontaktu ze skórą i oczami oraz jest niebezpieczny w przypadku spożycia i wdychania.
W przypadku kontaktu z oczami sprawdź, czy nosisz soczewki kontaktowe i natychmiast je zdejmij. Oczy należy przepłukiwać bieżącą wodą przez co najmniej 15 minut, trzymając powieki otwarte. Można użyć zimnej wody. Nie należy stosować maści do oczu.
Jeśli substancja chemiczna wejdzie w kontakt z ubraniem, zdejmij ją tak szybko, jak to możliwe, chroniąc własne ręce i ciało. Umieść ofiarę pod prysznicem bezpieczeństwa.
Jeśli substancja chemiczna gromadzi się na odsłoniętej skórze ofiary, takiej jak ręce, zanieczyszczoną skórę należy delikatnie i ostrożnie umyć pod bieżącą wodą i nieściernym mydłem..
Można użyć zimnej wody. Jeśli podrażnienie utrzymuje się, zasięgnąć porady lekarza. Wyprać zanieczyszczoną odzież przed ponownym użyciem.
W przypadku silnego kontaktu ze skórą należy ją przemyć mydłem dezynfekującym, a skażoną skórę pokryć kremem antybakteryjnym..
W przypadku wdychania poszkodowanego należy pozwolić odpocząć w dobrze wentylowanym miejscu. Jeśli wdychanie jest ciężkie, ofiarę należy jak najszybciej ewakuować w bezpieczne miejsce. Poluzuj ciasną odzież, taką jak kołnierzyk koszuli, pasek lub krawat.
Jeśli ofiara ma trudności z oddychaniem, należy podać tlen. Jeśli ofiara nie oddycha, przeprowadza się resuscytację usta-usta. Zawsze należy pamiętać, że wykonanie resuscytacji usta-usta może być niebezpieczne dla osoby udzielającej pomocy, gdy wdychany materiał jest toksyczny, zakaźny lub żrący..
W przypadku połknięcia nie wywoływać wymiotów. Poluzuj ciasne ubrania, takie jak kołnierzyki koszuli, paski lub krawaty. Jeśli ofiara nie oddycha, należy przeprowadzić resuscytację usta-usta. We wszystkich przypadkach zasięgnij natychmiastowej pomocy lekarskiej..
Aplikacje
Przeprowadzono badania, w których meta-stabilne roztwory kwasu chlorawego / tlenku chloru są stosowane jako płyn do płukania jamy ustnej w celu redukcji płytki nazębnej (Goultschin J, 1989).
Badanie zostało przeprowadzone na grupie 18 ochotników w wieku 20-27 lat. Zbadano jego wpływ na rozwój płytki nazębnej i liczbę bakterii w ślinie, uzyskując redukcję do 34,5% oceny płytki nazębnej w porównaniu z grupą placebo..
Kwas chlorawy bierze udział w wytwarzaniu kwaśnego chlorynu sodu, który ma właściwości przeciwdrobnoustrojowe i jest przeznaczony przede wszystkim do rozpylania lub zanurzania drobiu, mięs, warzyw, owoców i owoców morza. Stosowany również w wodzie chłodzącej drobiu.
Chloryn sodu jest wytwarzany przez dodanie kwasu spożywczego (na przykład kwasu cytrynowego, kwasu fosforowego, kwasu solnego, kwasu jabłkowego lub wodorosiarczanu sodu) do wodnego roztworu chlorynu sodu (NaClOdwa).
Połączenie kwasu z roztworem chlorynu sodu powoduje przemianę chlorynu w metastabilny kwas chlorawy (HClOdwa).
NaClOdwa + H.+ ⇌ HClOdwa + Na+
Roztwór ten może później tworzyć mieszaninę z chlorynem (ClOdwa-), dwutlenek chloru (ClOdwa) i chlorek (Cl¯). W wyniku reakcji powstaje utleniający roztwór z oksychlorowanymi związkami o właściwościach przeciwdrobnoustrojowych.
Chlorek kwasu sodowego jest przeznaczony do stosowania jako część zintegrowanego podejścia mającego na celu kontrolę obciążenia drobnoustrojami w żywności.
Roztwór chlorynu kwasu sodowego zmniejsza liczbę patogenów (na przykład Escherichia coli, E. coli O157: H7, Salmonella spp., Campylobacter spp. I Listeria monocytogenes) (Rao, 2006).
Bibliografia
- J. Downs, C. J. (1973). Chemia chloru, bromu, jodu i astatyny: Pergamon…, tom 7. New York: Pergamon press.
- C. Hong, W. H. (1968). Kinetyka dysproporcjonowania kwasu chlorawego. Canadian Journal of Chemistry 46 (12): , 2053-2060. nrcresearchpress.com.
- EMBL-EBI. (28 lipca 2014). kwas chlorawy. Odzyskany z ChEBI: ebi.ac.uk.
- Goultschin J, G. J. (1989). Stosowanie preparatu metastabilizowanego kwasu chlorawego / ditlenku chloru jako płynu do płukania ust w celu zmniejszenia płytki nazębnej. Isr J Dent Sci.2 (3), 142-147. ncbi.nlm.nih.gov.
- National Center for Biotechnology Information… (30 kwietnia 2017). Baza danych PubChem Compound CID = 24453. Odzyskane z PubChem.
- Rao, M. V. (2006, grudzień). ACIDIFIED SODIUM CHLORITE (ASC) Ocena chemiczna i techniczna. Odzyskany z fao.org.
- Królewskie Towarzystwo Chemii. (2015). Kwas chlorawy. Odzyskany z chemspider.com.


Jeszcze bez komentarzy