
Właściwości, zagrożenia i zastosowania kwasu fosforowego (H3PO3)

Plik kwas fosforowy, zwany także kwasem ortofosforawym, jest związkiem chemicznym o wzorze H.3PO3. Jest jednym z różnych utlenionych kwasów fosforu, a jego budowę przedstawiono na rysunku 1 (EMBL-EBI, 2015).
Biorąc pod uwagę wzór związku, można go przepisać jako HPO (OH)dwa. Gatunek ten istnieje w równowadze z mniejszym tautomerem P (OH)3 (Rysunek 2).

Zgodnie z zaleceniami IUPAC z 2005 roku ten ostatni nazywany jest kwasem fosforawym, podczas gdy forma dihydroksy nazywana jest kwasem fosfonowym. Tylko zredukowane związki fosforu są zapisywane z końcówką „niedźwiedź”..

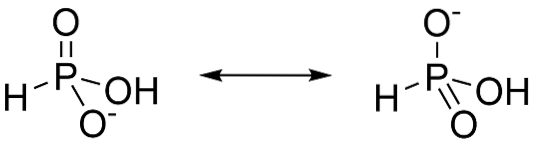
Kwas fosforowy jest kwasem diprotycznym, co oznacza, że ma zdolność oddawania tylko dwóch protonów. Dzieje się tak, ponieważ większość tautomerów to H.3PO3. Kiedy ten kształt traci proton, rezonans stabilizuje utworzone aniony, jak pokazano na rysunku 3.
Tautomer P (OH) 3 (Rysunek 4) nie zapewnia stabilizacji rezonansu. To sprawia, że usunięcie trzeciego protonu jest znacznie trudniejsze (Dlaczego kwas fosforowy jest diprotyczny, a nie trójprotyczny?, 2016).

Kwas fosforowy (H.3PO3) tworzy sole zwane fosforynami, które są stosowane jako środki redukujące (Britannica, 1998). Jest przygotowywany przez rozpuszczenie heksoksydu czterofosforowego (P.4LUB6) zgodnie z równaniem:
P.4LUB6 + 6 godzdwaO → 4 HPO (OH)dwa
Czysty kwas fosforawy, H.3PO3, najlepiej przygotowany przez hydrolizę trójchlorku fosforu, PCl3.
PCl3 + 3HdwaO → HPO (OH)dwa + 3HCl
Powstały roztwór ogrzewa się w celu usunięcia HCl, a pozostałą wodę odparowuje się, aż się pojawi 3PO3 bezbarwny krystaliczny podczas chłodzenia. Kwas można również otrzymać przez działanie wody na PBr3 lub PI3 (Zumdahl, 2018).
Indeks artykułów
- 1 Właściwości fizyczne i chemiczne
- 2 Reaktywność i zagrożenia
- 2.1 Reaktywność
- 2.2 Zagrożenia
- 2.3 Postępowanie w przypadku uszkodzenia
- 3 Zastosowania
- 4 Odnośniki
Fizyczne i chemiczne właściwości
Kwas fosforowy to białe lub żółte higroskopijne czterościenne kryształy o zapachu czosnku (National Center for Biotechnology Information, 2017).

H3PO3 ma masę cząsteczkową 82,0 g / mol i gęstość 1,651 g / ml. Związek ma temperaturę topnienia 73 ° C i rozkłada się powyżej 200 ° C. Kwas fosforowy jest rozpuszczalny w wodzie, będąc w stanie rozpuścić 310 gramów na 100 ml tego rozpuszczalnika. Jest również rozpuszczalny w etanolu.
Ponadto jest to mocny kwas o pKa między 1,3 a 1,6 (Royal Society of Chemistry, 2015).
Podgrzanie kwasu fosforowego do około 200 ° C powoduje jego dysproporcjonalne do kwasu fosforowego i fosfiny (PH3). Fosfina, gaz, który normalnie zapala się samorzutnie w powietrzu.
4H3PO3 + ciepło → PH3 + 3H3PO4
Reaktywność i zagrożenia
Reaktywność
- Kwas fosforowy nie jest stabilnym związkiem.
- Absorbuje tlen z powietrza, tworząc kwas fosforowy.
- W roztworze wodnym tworzy żółte osady, które po wyschnięciu są samorzutnie zapalne.
- Reaguje egzotermicznie z zasadami chemicznymi (na przykład z aminami i nieorganicznymi wodorotlenkami), tworząc sole.
- Reakcje te mogą generować niebezpiecznie duże ilości ciepła w małych przestrzeniach..
- Rozpuszczenie w wodzie lub rozcieńczenie stężonego roztworu dodatkową wodą może generować znaczne ciepło.
- Reaguje w obecności wilgoci z metalami aktywnymi, w tym metalami konstrukcyjnymi, takimi jak aluminium i żelazo, uwalniając wodór, łatwopalny gaz.
- Może zainicjować polimeryzację niektórych alkenów. Reaguje ze związkami cyjanku, uwalniając gazowy cyjanowodór.
- Może wytwarzać palne i / lub toksyczne gazy w kontakcie z ditiokarbaminianami, izocyjanianami, merkaptanami, azotkami, nitrylami, siarczkami i silnymi środkami redukującymi.
- Dodatkowe reakcje generujące gaz zachodzą z siarczynami, azotynami, tiosiarczanami (z wytworzeniem H2S i SO3), ditioninami (z wytworzeniem SO2) i węglanami (z wytworzeniem CO2) (KWAS FOSFOROWY, 2016).
Niebezpieczeństwa
- Związek działa żrąco na oczy i skórę.
- Kontakt z oczami może spowodować uszkodzenie rogówki lub ślepotę..
- Kontakt ze skórą może powodować stan zapalny i pęcherze.
- Wdychanie pyłu powoduje podrażnienie przewodu pokarmowego lub dróg oddechowych, objawiające się pieczeniem, kichaniem i kaszlem..
- Poważne nadmierne narażenie może spowodować uszkodzenie płuc, uduszenie, utratę przytomności lub śmierć (karta charakterystyki substancji niebezpiecznej Kwas fosforowy, 2013).
Działania w przypadku uszkodzenia
- Upewnienie się, że personel medyczny jest świadomy stosowanych materiałów i podejmuje środki ostrożności, aby się chronić.
- Poszkodowanego należy przenieść w chłodne miejsce i wezwać pogotowie ratunkowe.
- Jeśli ofiara nie oddycha, należy zastosować sztuczne oddychanie.
- Nie należy stosować metody usta-usta, jeśli ofiara połknęła lub wdychała substancję..
- Sztuczne oddychanie wykonuje się za pomocą maski kieszonkowej wyposażonej w zawór jednokierunkowy lub innego odpowiedniego respiratora.
- Jeśli oddychanie jest utrudnione, należy podać tlen.
- Zanieczyszczoną odzież i buty należy zdjąć i odizolować.
- W przypadku kontaktu z substancją natychmiast przemywać skórę lub oczy bieżącą wodą przez co najmniej 20 minut..
- Aby zmniejszyć kontakt ze skórą, należy unikać rozprowadzania materiału na zdrowej skórze..
- Utrzymuj ofiarę w spokoju i cieple.
- Skutki narażenia (wdychanie, spożycie lub kontakt ze skórą) na substancję mogą być opóźnione.
Aplikacje
Najważniejszym zastosowaniem kwasu fosforowego jest produkcja fosforynów, które są wykorzystywane do uzdatniania wody. Kwas fosforowy jest również używany do wytwarzania soli fosforynowych, takich jak fosforyn potasu..
Wykazano, że fosforyny są skuteczne w zwalczaniu różnych chorób roślin.
W szczególności leczenie poprzez iniekcję pnia lub dolistne zawierające sole kwasu fosforowego jest wskazane w odpowiedzi na infekcje patogenami roślin typu fitoftera i pythium (powodują one rozkład korzeni).
Kwas fosforowy i fosforyny są używane jako czynniki redukujące w analizie chemicznej. Wygodna i skalowalna nowa synteza kwasów fenylooctowych, poprzez katalizowaną jodkiem redukcję kwasów migdałowych, oparta jest na wytwarzaniu in situ kwasu jodowodorowego z katalitycznego jodku sodu. W tym celu kwas fosforowy jest stosowany jako reduktor stechiometryczny (Jacqueline E. Milne, 2011).
Stosowany jest jako składnik do produkcji dodatków stosowanych w przemyśle polichlorku winylu (kwas fosforawy (CAS RN 10294-56-1), 2017). W różnych reakcjach syntezy organicznej wykorzystuje się także estry kwasu fosforowego (Błażewska, 2009).
Bibliografia
- Błażewska, K. (2009). Science of Synthesis: Houben-Weyl Methods of Molecular Transformations tom 42. New York: Thieme.
- (1998, 20 lipca). Kwas fosforowy (H3PO3). Odzyskane z Encyclopædia Britannica: britannica.com.
- EMBL-EBI. (2015, 20 lipca). kwas fosfonowy. Odzyskany z ebi.ac.uk: ebi.ac.uk.
- Jacqueline E. Milne, T. S. (2011). Jodide-Catalyzed Reductions: Development of a Synthesis of Phenylacetic Acids. Org. Chem., 76, 9519-9524. organic-chemistry.org.
- Karta charakterystyki substancji niebezpiecznej Kwas fosforowy. (2013, 21 maja). Odzyskany z sciencelab: sciencelab.com.
- Narodowe Centrum Informacji Biotechnologicznej. (2017, 11 marca). Baza danych PubChem Compound; CID = 107909. Pobrane z PubChem: ncbi.nlm.nih.gov.
- Kwas fosforowy (CAS RN 10294-56-1). (2017, 15 marca). Odzyskany z gov.uk/trade-tariff:gov.uk.
- KWAS FOSFOROWY. (2016). Odzyskany z cameochemicals: cameochemicals.noaa.gov.
- Królewskie Towarzystwo Chemii. (2015). KWAS FOSFOROWY. Odzyskany z chemspider: chemspider.com.
- Dlaczego kwas fosforawy jest diprotyczny, a nie trójprotyczny? (11 marca 2016). Odzyskany z chemistry.stackexchange.
- Zumdahl, S. S. (15 sierpnia 2018). Oxyacid. Odzyskany z britannica.com.


Jeszcze bez komentarzy