
Struktura, właściwości, synteza kwasu azotowego (HNO2)

Plik kwas azotowy to słaby kwas nieorganiczny, którego wzór chemiczny to HNOdwa. Występuje głównie w roztworze wodnym o jasnoniebieskim kolorze. Jest bardzo niestabilny i szybko rozkłada się na tlenek azotu, NO i kwas azotowy, HNO3.
Zwykle występuje w roztworze wodnym w postaci azotynów. Pochodzi również naturalnie z atmosfery w wyniku reakcji tlenku azotu z wodą. Tam, szczególnie w troposferze, kwas azotowy wpływa na regulację stężenia ozonu.

Rozwiązanie HNO pokazano na powyższym obrazkudwa gdzie docenia się charakterystyczny bladoniebieski kolor tego kwasu. Jest syntetyzowany przez rozpuszczenie trójtlenku azotu, NdwaLUB3, w wodzie. Podobnie jest produktem zakwaszania roztworów azotynu sodu w niskich temperaturach..
HNOdwa Ma niewielkie zastosowanie komercyjne, ponieważ jest używany w postaci azotynów do konserwowania mięsa. Z drugiej strony jest używany do produkcji barwników azowych.
Jest stosowany w połączeniu z tiosiarczanem sodu w leczeniu pacjentów z zatruciem cyjankiem sodu. Ale jest to czynnik mutagenny i uważa się, że może powodować substytucje w zasadach łańcuchów DNA poprzez oksydacyjną deaminację cytozyny i adeniny..
Kwas azotowy ma podwójne zachowanie, ponieważ może zachowywać się jako środek utleniający lub redukujący; to znaczy, można go zredukować do NO lub N.dwa, utlenia się do HNO3.
Indeks artykułów
- 1 Struktura kwasu azotawego
- 2 Właściwości
- 2.1 Nazwy chemiczne
- 2.2 Opis fizyczny
- 2.3 Masa cząsteczkowa
- 2.4 Stała dysocjacji
- 2.5 Temperatura topnienia
- 2.6 Temperatura wrzenia
- 2.7 Tworzenie soli
- 2.8 Potencjał pożarowy
- 2.9 Rozkład
- 2.10 Środek redukujący
- 2.11 Środek utleniający
- 3 Nazewnictwo
- 4 Synteza
- 5 Ryzyka
- 6 zastosowań
- 6.1 Produkcja soli diazoniowych
- 6.2 Usuwanie azydku sodu
- 6.3 Synteza oksymów
- 6.4 W postaci soli
- 7 Referencje
Struktura kwasu azotowego
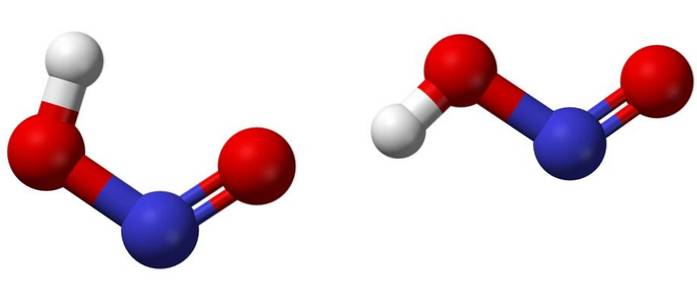
Górny obraz przedstawia strukturę molekularną kwasu azotawego za pomocą modelu kul i prętów. Atom azotu (niebieska kula) znajduje się w środku struktury, tworząc wiązanie podwójne (N = O) i pojedyncze (N-O) z atomami tlenu (kule czerwone).
Zauważ, że atom wodoru (biała kula) jest związany z jednym z atomów tlenu, a nie bezpośrednio z azotem. A więc wiedząc o tym, wzór strukturalny HNOdwa to [HO-N = O] lub [NO (OH)] i nie ma takiego wiązania H-N (jak może sugerować wzór chemiczny).
Cząsteczki na obrazie odpowiadają cząsteczkom fazy gazowej; w wodzie są otoczone cząsteczkami wody, które mogą przyjąć (słabo) jon wodorowy, tworząc jony NOdwa- i H3LUB+.
Ich struktury mogą przybierać dwie formy: cis lub trans, zwane izomerami geometrycznymi. W izomerze cis atom H jest zaćmiony przez sąsiedni atom tlenu; podczas gdy w izomerze trans oba są w pozycji przeciwnej lub przeciwnej.
W izomerze cis prawdopodobne jest utworzenie wewnątrzcząsteczkowego mostka wodorowego (OH-NO), który może zaburzyć mostek międzycząsteczkowy (ONOH-ONOH)..
Nieruchomości
Nazwy chemiczne
-Kwas azotowy
-Kwas dioksonitrynowy (III)
-Wodorotlenek nitrozylu
-Wodorotlenek tlenku azotu (nazwa systemowa IUPAC)
Opis fizyczny
Bladoniebieski płyn, odpowiadający roztworowi azotynów.
Waga molekularna
47,013 g / mol.
Stała dysocjacji
To słaby kwas. Jego pKa wynosi 3,35 przy 25ºC.
Temperatura topnienia
Jest znany tylko w rozwiązaniu. Dlatego nie można obliczyć jego temperatury topnienia ani wyodrębnić jego kryształów..
Temperatura wrzenia
Ponieważ nie istnieje w stanie czystym, ale w wodzie, pomiary tej właściwości nie są dokładne. Z jednej strony zależy to od stężenia HNOdwa, z drugiej strony jego ogrzewanie powoduje jego rozkład. Dlatego nie podaje się dokładnej temperatury wrzenia..
Tworzenie soli
Z Li tworzy rozpuszczalne w wodzie azotyny+, Na+, K.+, ACdwa+, Pandwa+, Badwa+. Nie tworzy jednak soli z wielowartościowymi kationami, takimi jak: Al3+ i / lub Bedwa+ (ze względu na dużą gęstość ładunku). Jest zdolny do tworzenia trwałych estrów z alkoholami.
Potencjał ognia
Jest palny w wyniku reakcji chemicznych. Może wybuchnąć w kontakcie z trójchlorkiem fosforu.
Rozkład
Jest związkiem bardzo nietrwałym, w roztworze wodnym rozkłada się na tlenek azotu i kwas azotowy:
2 HNOdwa => NIEdwa + NO + HdwaLUB
4 HNOdwa => 2 HNO3 + NdwaO + HdwaLUB
Środek redukujący
Kwas azotowy w roztworze wodnym występuje w postaci jonów azotynowych, NOdwa-, które podlegają różnym reakcjom redukcji.
Reaguje z jonami I.- i wiarydwa+, w postaci azotynu potasu, z wytworzeniem tlenku azotu:
2 KNOdwa + KI + Hdwapołudniowy zachód4 => Idwa + 2 NO + 2 HdwaO + Kdwapołudniowy zachóddwa
Azotyn potasu w obecności jonów cyny jest redukowany do podtlenku azotu:
KNOdwa + 6 HCl + 2 SnCldwa => 2 SnCl4 + NdwaO + 3 H.dwaO + 2 KCl
Azotyn potasu jest redukowany przez Zn w środowisku zasadowym, tworząc amoniak:
5 godzdwaO + KNOdwa + 3 Zn => NH3 + KOH + 3 Zn (OH)dwa
Środek utleniający
Oprócz tego, że jest środkiem redukującym, kwas azotawy może wpływać na procesy utleniania. Na przykład: utlenia siarkowodór, zamieniając się w tlenek azotu lub amoniak, w zależności od kwasowości środowiska, w którym zachodzi reakcja.
2 HNOdwa + H.dwaS => S + 2 NO + 2 H.dwaLUB
HNOdwa + 3 HdwaS => S + NH3 + 2 godzdwaLUB
Kwas azotowy w środowisku o kwaśnym pH może utleniać jodki do jodu.
HNOdwa + ja- + 6 godz+ => 3 I.dwa + NH3 + 2 godzdwaLUB
Może również działać jako środek redukujący, działając na Cudwa+, dając początek kwasowi azotowemu.
Nomenklatura
Do HNOdwa Można mu nadać inne nazwy, które zależą od rodzaju nomenklatury. Kwas azotowy odpowiada tradycyjnej nomenklaturze; kwas dioksonitrynowy (III), zgodnie z nomenklaturą zapasów; i dioksonitan wodoru (III), do systematycznego.
Synteza
Kwas azotowy można syntetyzować rozpuszczając trójtlenek azotu w wodzie:
NdwaLUB3 + H.dwaO => 2 HNOdwa
Inną metodą przygotowania jest reakcja azotynu sodu NaNO3, z kwasami mineralnymi; taki jak kwas solny i kwas bromowodorowy. Reakcję prowadzi się w niskiej temperaturze, a kwas azotawy zużywa się in situ..
Starszy brat3 + H.+ => HNOdwa + Na+
Jon H.+ pochodzi z HCl lub HBr.
Ryzyka
Biorąc pod uwagę jego właściwości i charakterystykę chemiczną, niewiele jest informacji na temat bezpośrednich toksycznych skutków HNO.dwa. Być może niektóre szkodliwe skutki, które uważa się za wytwarzane przez ten związek, są w rzeczywistości powodowane przez kwas azotowy, który może być spowodowany rozkładem kwasu azotawego.
Należy zauważyć, że HNOdwa może mieć szkodliwy wpływ na drogi oddechowe i powodować objawy drażniące u pacjentów z astmą.
W postaci azotynu sodu jest redukowany przez dezoksyhemoglobinę, z wytworzeniem tlenku azotu. Jest to silny środek rozszerzający naczynia krwionośne, który powoduje rozluźnienie mięśni gładkich naczyń, szacując dawkę LD50 na 35 mg / kg do spożycia doustnego u ludzi..
Toksyczność azotynu sodu objawia się zapaścią sercowo-naczyniową, po której następuje ciężkie niedociśnienie spowodowane rozszerzającym naczynia krwionośne działaniem tlenku azotu wytwarzanego z azotynów..
Dwutlenek azotu, NOdwa, obecny w zanieczyszczonym powietrzu (smogu), w określonych warunkach może powodować kwas azotowy; które z kolei mogą reagować z aminami, tworząc nitrozoaminy, gamma związków rakotwórczych.
Podobna reakcja występuje w przypadku dymu papierosowego. Stwierdzono, że pozostałości nitrozoaminy przylegają do wykładzin wewnętrznych pojazdów dla palaczy.
Aplikacje
Produkcja soli diazoniowych
Kwas azotowy wykorzystywany jest w przemyśle do produkcji soli diazoniowych poprzez jego reakcję z aminami aromatycznymi i fenolami.
HNOdwa + ArNHdwa + H.+ => ArN = NAr + HdwaLUB
Sole diazoniowe są używane w reakcjach syntezy organicznej; na przykład w reakcji Sandmeyera. W tej reakcji podstawienie grupy aminowej (HdwaN-), w pierwszorzędowej aminie aromatycznej, przez grupy Cl-, Br- i CN-. Aby otrzymać te aromatyczne produkty, potrzebne są sole miedziawy.
Sole diazoniowe mogą tworzyć jasne związki azowe, które są używane jako barwniki, a także służą jako jakościowy test na obecność amin aromatycznych..
Usuwanie azydku sodu
Kwas azotowy służy do usuwania azydku sodu (NaN3), który jest potencjalnie niebezpieczny ze względu na tendencję do wybuchania.
2 NaN3 + 2 HNOdwa => 3 N.dwa + 2 NO + 2 NaOH
Synteza oksymów
Kwas azotowy może reagować z grupami ketonowymi, tworząc oksymy. Można je utlenić do kwasów karboksylowych lub zredukować do amin..
Proces ten jest wykorzystywany do komercyjnego wytwarzania kwasu adypinowego, monomeru używanego do produkcji nylonu. Zajmuje się również produkcją poliuretanu, a jego estry to plastyfikatory, głównie PVC.
W postaci soli
Kwas azotowy w postaci azotynu sodu jest stosowany do obróbki i konserwowania mięsa; ponieważ zapobiega rozwojowi bakterii i jest w stanie reagować z mioglobiną, wytwarzając ciemnoczerwony kolor, który sprawia, że mięso jest bardziej atrakcyjne do spożycia.
Ta sama sól jest stosowana razem z tiosiarczanem sodu w dożylnym leczeniu zatrucia cyjankiem sodu..
Bibliografia
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. Aminy. (10th wydanie.). Wiley plus.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- PubChem. (2019). Kwas azotowy. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Softschools. (2019). Kwas azotowy. Odzyskane z: Softschools.com
- Wikipedia. (2019). Kwas azotowy. Odzyskane z: en.wikipedia.org
- Królewskie Towarzystwo Chemii. (2015). Kwas azotowy. Źródło: chemspider.com
- Encyklopedia Nowego Świata. (2015). Kwas azotowy. Odzyskane z: newworldencyclopedia.org
- DrugBank. (2019). Kwas azotowy. Odzyskany z: drugbank.ca
- Formulacja chemiczna. (2018). HNOdwa. Odzyskany z: formulacionquimica.com



Jeszcze bez komentarzy