
Struktura, właściwości, synteza i zastosowania kwasu azotowego (HNO3)
Plik kwas azotowy Jest to nieorganiczny związek składający się z okso kwasu azotowego. Uważany jest za mocny kwas, chociaż jego pKa (-1,4) jest podobne do pKa jonu hydroniowego (-1,74). Od tego momentu jest prawdopodobnie „najsłabszym” z wielu znanych silnych kwasów..
Jego wygląd fizyczny składa się z bezbarwnej cieczy, która podczas przechowywania zmienia kolor na żółtawy w wyniku tworzenia się gazów azotowych. Jego wzór chemiczny to HNO3.

Jest nieco niestabilny, ulega lekkiemu rozkładowi pod wpływem światła słonecznego. Ponadto może zostać całkowicie rozłożony przez ogrzewanie, powodując powstanie dwutlenku azotu, wody i tlenu..
Zdjęcie powyżej przedstawia kwas azotowy zawarty w kolbie miarowej. Można zauważyć jego żółte zabarwienie wskazujące na częściowy rozkład.
Znajduje zastosowanie w produkcji azotanów nieorganicznych i organicznych, a także w związkach nitrozowych, które są wykorzystywane do produkcji nawozów, materiałów wybuchowych, półproduktów do barwników i różnych organicznych związków chemicznych..
Kwas ten był już znany alchemikom w VIII wieku, który nazywali „agua fortis”. Niemiecki chemik Johan Rudolf Glauber (1648) opracował metodę jej przygotowania polegającą na podgrzaniu azotanu potasu kwasem siarkowym.
Jest przygotowywany przemysłowo według metody opracowanej przez Wilhelma Oswalda (1901). Metoda polega na ogół na katalitycznym utlenianiu amonu z sukcesywnym wytwarzaniem tlenku azotu i dwutlenku azotu w celu utworzenia kwasu azotowego..
W atmosferze NIEdwa wytwarzany w wyniku działalności człowieka reaguje z wodą mętną, tworząc HNO3. Następnie podczas kwaśnych deszczy wytrąca się wraz z kroplami wody, pożerając np. Posągi na publicznych placach..
Kwas azotowy jest bardzo toksycznym związkiem, a ciągłe narażenie na jego opary może prowadzić do przewlekłego zapalenia oskrzeli i chemicznego zapalenia płuc..
Indeks artykułów
- 1 Struktura kwasu azotowego
- 1.1 Struktury rezonansowe
- 2 Właściwości fizyczne i chemiczne
- 2.1 Nazwy chemiczne
- 2.2 Masa cząsteczkowa
- 2.3 Wygląd fizyczny
- 2.4 Zapach
- 2.5 Temperatura wrzenia
- 2.6 Temperatura topnienia
- 2.7 Rozpuszczalność w wodzie
- 2.8 Gęstość
- 2.9 Gęstość względna
- 2.10 Względna gęstość oparów
- 2.11 Prężność par
- 2.12 Rozkład
- 2.13 Lepkość
- 2.14 Korozja
- 2.15 Molowa entalpia parowania
- 2.16 Standardowa entalpia molowa
- 2.17 Standardowa entropia molowa
- 2.18 Napięcie powierzchniowe
- 2.19 Próg zapachu
- 2.20 Stała dysocjacji
- 2.21 Współczynnik załamania światła (η / D)
- 2.22 Reakcje chemiczne
- 3 Synteza
- 3.1 Przemysłowe
- 3.2 W laboratorium
- 4 Zastosowania
- 4.1 Produkcja nawozów
- 4.2 Przemysłowe
- 4.3 Oczyszczacz metalu
- 4.4 Aqua regia
- 4.5 Meble
- 4.6 Czyszczenie
- 4.7 Fotografia
- 4.8 Inne
- 5 Toksyczność
- 6 Odnośniki
Struktura kwasu azotowego
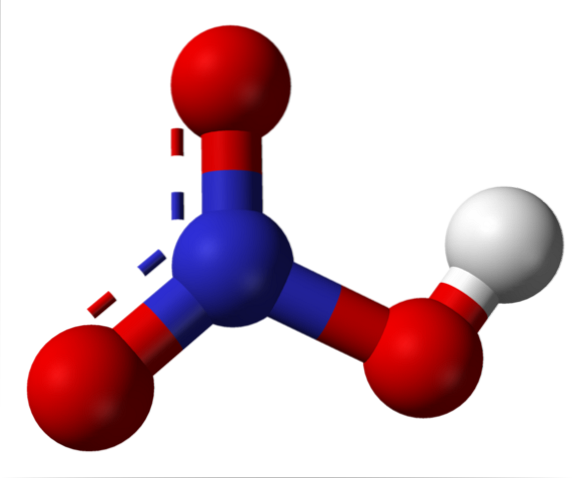
Górny obraz przedstawia strukturę cząsteczki HNO.3 z modelem kul i prętów. Atom azotu, niebieska kula, znajduje się w środku, otoczona trygonalną geometrią płaszczyzny; jednak trójkąt jest zniekształcony przez jeden z jego najdłuższych wierzchołków.
Cząsteczki kwasu azotowego są wtedy płaskie. Wiązania N = O, N-O i N-OH tworzą wierzchołki płaskiego trójkąta. Jeśli obserwuje się szczegółowo, wiązanie N-OH jest bardziej wydłużone niż dwa pozostałe (gdzie znajduje się biała kula reprezentująca atom H).
Struktury rezonansowe
Istnieją dwa wiązania o tej samej długości: N = O i N-O. Fakt ten jest sprzeczny z teorią wiązań walencyjnych, w której przewiduje się, że podwójne wiązania będą krótsze niż pojedyncze. Wyjaśnienie tego leży w zjawisku rezonansu, jak widać na poniższym obrazku.

Oba wiązania, N = O i N-O, są zatem równoważne pod względem rezonansu. Jest to przedstawione graficznie w modelu struktury za pomocą przerywanej linii między dwoma atomami O (patrz struktura).
Kiedy HNO jest deprotonowany3, powstaje stabilny azotan anionowy NO3-. W nim rezonans obejmuje teraz wszystkie trzy atomy O. To jest powód, dla którego HNO3 ma wysoką kwasowość Bronsteda-Lowry'ego (gatunki dawców jonów H+).
Fizyczne i chemiczne właściwości
Nazwy chemiczne
-Kwas azotowy
-Kwas azotowy
-Azotan wodoru
-Woda Fortis.
Waga molekularna
63,012 g / mol.
Wygląd fizyczny
Bezbarwny lub bladożółty płyn, który może zmienić kolor na czerwonawo-brązowy.
Zapach
Ostry, duszący charakter.
Temperatura wrzenia
181ºF do 760 mmHg (83ºC).
Temperatura topnienia
-41,6 ° C.
Rozpuszczalność w wodzie
Bardzo dobrze rozpuszczalny i mieszalny z wodą.
Gęstość
1,513 g / cm3 przy 20 ºC.
Gęstość względna
1,50 (w stosunku do wody = 1).
Względna gęstość oparów
2 lub 3 razy oszacowane (w odniesieniu do powietrza = 1).
Ciśnienie pary
63,1 mmHg w 25 ° C.
Rozkład
Pod wpływem wilgoci lub ciepła atmosferycznego może ulec rozkładowi, tworząc nadtlenek azotu. Po podgrzaniu do rozkładu wydziela bardzo toksyczne opary tlenku azotu i azotanu wodoru..
Kwas azotowy nie jest stabilny, może rozkładać się pod wpływem ciepła i promieni słonecznych oraz wydziela dwutlenek azotu, tlen i wodę..
Lepkość
1092 mPa w 0 ° C i 0,617 mPa w 40 ° C.
Korozja
Jest zdolny do atakowania wszystkich metali nieszlachetnych z wyjątkiem aluminium i stali chromowej. Działa niszcząco na niektóre odmiany tworzyw sztucznych, gumy i powłoki. Jest to substancja żrąca i żrąca, dlatego należy obchodzić się z nią z najwyższą ostrożnością.
Entalpia molowa parowania
39,1 kJ / mol w 25 ºC.
Standardowa entalpia molowa
-207 kJ / mol (298 ºF).
Standardowa entropia molowa
146 kJ / mol (298 ºF).
Napięcie powierzchniowe
-0,04356 N / m przy 0 ºC
-0,04115 N / m przy 20 ° C
-0,0376 N / m przy 40 ºC
Próg zapachu
-Słaby zapach: 0,75 mg / m3
-Silny zapach: 250 mg / m3
-Stężenie drażniące: 155 mg / m3.
Stała dysocjacji
pKa = -1,38.
Współczynnik załamania (η / D)
1,393 (16,5 ° C).
Reakcje chemiczne
Uwodnienie
-Może tworzyć stałe hydraty, takie jak HNO3∙ H.dwaO i HNO3∙ 3HdwaLub: „lód azotowy”.
Dysocjacja w wodzie
Kwas azotowy jest silnym kwasem, który szybko jonizuje w wodzie w następujący sposób:
HNO3 (l) + HdwaO (l) => H.3LUB+ (ac) + NIE3-
Tworzenie soli
Reaguje z tlenkami zasadowymi, tworząc sól azotanową i wodę.
CaO (s) + 2 HNO3 (l) => Ca (NO3)dwa (ac) + HdwaO (l)
Podobnie reaguje z zasadami (wodorotlenkami), tworząc sól azotanu i wody..
NaOH (aq) + HNO3 (l) => NaNO3 (ac) + HdwaO (l)
A także z węglanami i kwaśnymi węglanami (wodorowęglanami), również tworzącymi dwutlenek węgla.
NadwaWSPÓŁ3 (ac) + HNO3 (l) => NaNO3 (ac) + HdwaO (l) + COdwa (sol)
Protonacja
Kwas azotowy może również zachowywać się jak zasada. Z tego powodu może reagować z kwasem siarkowym.
HNO3 + 2Hdwapołudniowy zachód4 <=> NIEdwa+ + H.3LUB+ + 2HSO4-
Autoprotoliza
Kwas azotowy ulega autoprotolizie.
2HNO3 <=> NIEdwa+ + NIE3- + H.dwaLUB
Utlenianie metali
W reakcji z metalami kwas azotowy nie zachowuje się jak mocne kwasy, które reagują z metalami, tworząc odpowiednią sól i uwalniając wodór w postaci gazowej..
Jednak magnez i mangan reagują na gorąco z kwasem azotowym, podobnie jak inne mocne kwasy..
Mg (s) + 2 HNO3 (l) => Mg (NO3)dwa (ac) + Hdwa (sol)
Inny
Kwas azotowy reaguje z siarczynami metali, tworząc sól azotanową, dwutlenek siarki i wodę..
Nadwapołudniowy zachód3 (s) + 2 HNO3 (l) => 2 NaNO3 (ac) + SOdwa (g) + HdwaO (l)
A także reaguje ze związkami organicznymi, zastępując atom wodoru grupą nitrową; stanowiąc tym samym podstawę do syntezy związków wybuchowych, takich jak nitrogliceryna i trinitrotoluen (TNT).
Synteza
Przemysłowy
Jest produkowany na poziomie przemysłowym poprzez katalityczne utlenianie amonu, zgodnie z metodą opisaną przez Oswalda w 1901 roku. Procedura składa się z trzech etapów lub etapów..
Etap 1: utlenianie amonu do tlenku azotu
Amoniak jest utleniany przez tlen w powietrzu. Reakcję prowadzi się w 800ºC i pod ciśnieniem 6-7 atm, z użyciem platyny jako katalizatora. Amoniak miesza się z powietrzem w stosunku: 1 objętość amoniaku na 8 objętości powietrza.
4NH3 (g) + 5Odwa (g) => 4NO (g) + 6HdwaO (l)
W wyniku reakcji powstaje tlenek azotu, który trafia do komory utleniania w kolejnym etapie..
Etap 2. Utlenianie tlenku azotu do dwutlenku azotu
Utlenianie jest przeprowadzane przez tlen obecny w powietrzu w temperaturze poniżej 100 ° C.
2NO (g) + Odwa (g) => 2NOdwa (sol)
Etap 3. Rozpuszczenie dwutlenku azotu w wodzie
Na tym etapie następuje tworzenie się kwasu azotowego.
4NOdwa + 2HdwaO + Odwa => 4HNO3
Istnieje kilka metod absorpcji dwutlenku azotu (NOdwa) w wodzie.
Wśród innych metod: NIEdwa jest dimeryzowana do N.dwaLUB4 w niskich temperaturach i wysokim ciśnieniu w celu zwiększenia jego rozpuszczalności w wodzie i wytworzenia kwasu azotowego.
3NdwaLUB4 + 2HdwaO => 4HNO3 + 2NO
Kwas azotowy wytwarzany przez utlenianie amoniaku ma stężenie między 50-70%, które można doprowadzić do 98%, stosując stężony kwas siarkowy jako środek odwadniający, co pozwala na zwiększenie stężenia kwasu azotowego..
W laboratorium
Rozkład termiczny azotanu miedzi (II), z wytworzeniem dwutlenku azotu i gazów tlenowych, które przechodzą przez wodę, tworząc kwas azotowy; jak w opisanej wcześniej metodzie Oswalda.
2Cu (NIE3)dwa => 2CuO + 4NOdwa + LUBdwa
Reakcja soli azotanowej z Hdwapołudniowy zachód4 stężony. Powstały kwas azotowy oddziela się od Hdwapołudniowy zachód4 przez destylację w temperaturze 83 ° C (temperatura wrzenia kwasu azotowego).
KNO3 + H.dwapołudniowy zachód4 => HNO3 + KHSO4
Aplikacje
Produkcja nawozów
60% produkcji kwasu azotowego jest wykorzystywane do produkcji nawozów, zwłaszcza saletry amonowej.
Charakteryzuje się wysokim stężeniem azotu, jednego z trzech głównych składników odżywczych roślin, azotanu, który rośliny są natychmiast zużywane. W międzyczasie amoniak jest utleniany przez mikroorganizmy obecne w glebie i jest używany jako długotrwały nawóz..
Przemysłowy
-Do produkcji włókien syntetycznych zużywa się 15% kwasu azotowego.
-Wykorzystywany jest do produkcji estrów kwasu azotowego i pochodnych nitrowych; takie jak nitroceluloza, farby akrylowe, nitrobenzen, nitrotoluen, akrylonitryle itp..
-Może dodawać grupy nitrowe do związków organicznych, a tę właściwość można wykorzystać do wytwarzania materiałów wybuchowych, takich jak nitrogliceryna i trinitrotoluen (TNT)..
-Kwas adypinowy, prekursor nylonu, jest produkowany na dużą skalę przez utlenianie cykloheksanonu i cykloheksanolu kwasem azotowym..
Oczyszczacz metalu
Kwas azotowy ze względu na swoje właściwości utleniające jest bardzo przydatny w oczyszczaniu metali obecnych w minerałach. Stosuje się go również do otrzymywania pierwiastków takich jak uran, mangan, niob, cyrkon oraz do zakwaszania skał fosforowych w celu uzyskania kwasu fosforowego..
Królewska woda
Po zmieszaniu ze stężonym kwasem solnym tworzy „wodę królewską”. Roztwór ten jest w stanie rozpuszczać złoto i platynę, co pozwala na jego wykorzystanie do oczyszczania tych metali..
Meble
Kwas azotowy służy do uzyskania efektu antycznego w meblach wykonanych z drewna sosnowego. Obróbka 10% roztworem kwasu azotowego powoduje uzyskanie szaro-złotego zabarwienia drewna w meblach.
Czyszczenie
-Mieszanina wodnych roztworów kwasu azotowego 5-30% i kwasu fosforowego 15-40% stosowana jest do czyszczenia sprzętu używanego w pracach udojowych w celu usunięcia pozostałości osadów związków magnezu i wapnia..
-Przydaje się do czyszczenia szkła laboratoryjnego.
Fotografia
-Kwas azotowy był używany w fotografii, w szczególności jako dodatek do wywoływaczy siarczanu żelazawego w procesie mokrej płytki, w celu promowania bielszego koloru ambrotypów i tintypów..
-Zastosowano go do obniżenia pH kąpieli srebrnej płytek kolodionowych, co pozwoliło na zmniejszenie pojawiania się mgły zakłócającej obrazy.
Inni
-Ze względu na swoją zdolność do rozpuszczania jest stosowany w analizie różnych metali metodami płomieniowej spektrofotometrii absorpcji atomowej oraz spektrofotometrii mas z plazmą sprzężoną indukcyjnie..
-Połączenie kwasu azotowego i kwasu siarkowego zostało użyte do konwersji zwykłej bawełny w azotan celulozy (bawełna azotowa).
-Lek Salcoderm do użytku zewnętrznego jest stosowany w leczeniu łagodnych nowotworów skóry (brodawki, odciski, kłykciny i brodawczaki). Posiada właściwości kauteryzacyjne, łagodzące ból, podrażnienia i swędzenie. Kwas azotowy jest głównym składnikiem preparatu.
-Czerwony dymiący kwas azotowy i biały dymiący kwas azotowy są stosowane jako utleniacze w ciekłych paliwach rakietowych, zwłaszcza w pocisku BOMARC..
Toksyczność
-W kontakcie ze skórą może powodować oparzenia skóry, silny ból i zapalenie skóry..
-W kontakcie z oczami może powodować silny ból, łzawienie, aw ciężkich przypadkach uszkodzenie rogówki i ślepotę..
-Wdychanie oparów może powodować kaszel, niewydolność oddechową, krwawienie z nosa, zapalenie krtani, przewlekłe zapalenie oskrzeli, zapalenie płuc i obrzęk płuc w przypadku ciężkiego lub przewlekłego narażenia..
-W wyniku jego połknięcia dochodzi do zmian w jamie ustnej, ślinienia, silnego pragnienia, bólu przy połykaniu, silnego bólu w całym przewodzie pokarmowym i ryzyka przedziurawienia jego ściany..
Bibliografia
- Wikipedia. (2018). Kwas azotowy. Odzyskane z: en.wikipedia.org
- PubChem. (2018). Kwas azotowy. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Redaktorzy Encyclopaedia Britannica. (23 listopada 2018). Kwas azotowy. Encyclopædia Britannica. Odzyskany z: britannica.com
- Shrestha B. (s.f.). Właściwości i zastosowania kwasu azotowego. Przewodnik po chemii: tutoriale do nauki chemii. Źródło: chem-guide.blogspot.com
- Książka chemiczna. (2017). Kwas azotowy. Odzyskane z: chemicalbook.com
- Imanol. (10 września 2013). Produkcja kwasu azotowego. Odzyskany z: ingenieriaquimica.net



Jeszcze bez komentarzy