
Budowa, synteza, właściwości i zastosowania kwasu pikrynowego
Plik kwas pikrynowy jest silnie nitrowanym organicznym związkiem chemicznym, którego nazwa IUPAC to 2,4,6-trinitrofenol. Jego wzór cząsteczkowy to C.6H.dwa(NIEdwa)3O. Jest to bardzo kwaśny fenol i można go znaleźć w postaci pikrynianu sodu, amonu lub potasu; to znaczy w jego jonowej formie C.6H.dwa(NIEdwa)3Na.
Jest to ciało stałe o silnym gorzkim smaku, stąd jego nazwa pochodzi od greckiego słowa „prikos”, co oznacza gorzki. Występuje jako mokre żółte kryształy. Jego wysuszenie lub odwodnienie jest niebezpieczne, ponieważ zwiększa niestabilne właściwości, które powodują, że jest wybuchowy.
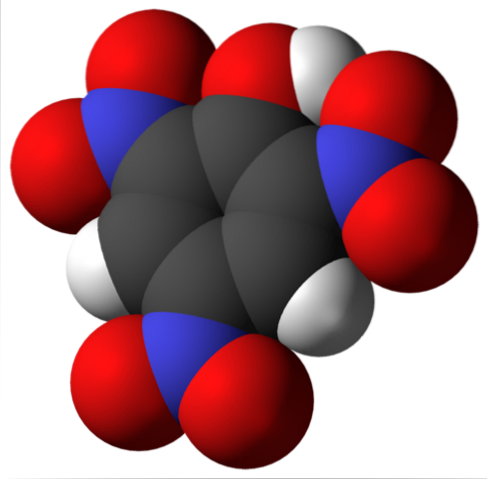
Cząsteczka kwasu pikrynowego jest pokazana powyżej. Na obrazie trudno jest rozpoznać wiązania i atomy, ponieważ odpowiada to reprezentacji jego powierzchni Van der Waalsa. W następnej części omówiono bardziej szczegółowo strukturę molekularną..
Niektóre związki pośrednie, różne sole pikrynianów i kompleksy kwasu pikrynowego są syntetyzowane z kwasu pikrynowego..
Kwas pikrynowy służy jako baza do syntezy trwałych żółtych barwników. Niektórzy patolodzy i badacze używają go do utrwalania lub barwienia skrawków tkanek i innych procesów immunohistochemicznych..
Jest bardzo przydatny przy wytwarzaniu produktów farmaceutycznych. Ponadto znajduje zastosowanie w produkcji zapałek i materiałów wybuchowych. Służy również do wytrawiania metali, do produkcji szkła barwionego oraz do kolorymetrycznego oznaczania parametrów biologicznych, takich jak kreatynina..
Z drugiej strony kwas pikrynowy działa drażniąco w kontakcie ze skórą, błoną śluzową dróg oddechowych, oczu i przewodu pokarmowego. Oprócz uszkadzania skóry może poważnie wpływać między innymi na nerki, krew i wątrobę..
Indeks artykułów
- 1 Struktura
- 1.1 Kwaśny fenol
- 1.2 Struktura kryształu
- 2 Synteza
- 2.1 Bezpośrednie nitrowanie fenolu
- 3 Właściwości fizyczne i chemiczne
- 3.1 Masa cząsteczkowa
- 3.2 Wygląd fizyczny
- 3.3 Zapach
- 3.4 Smak
- 3.5 Temperatura topnienia
- 3.6 Temperatura wrzenia
- 3.7 Gęstość
- 3.8 Rozpuszczalność
- 3.9 Korozyjność
- 3,10 pKa
- 3.11 Niestabilność
- 4 Zastosowania
- 4.1 Badania
- 4.2 Chemia organiczna
- 4.3 W przemyśle
- 4.4 Zastosowania wojskowe
- 5 Toksyczność
- 6 Odnośniki
Struktura

Górny obraz przedstawia bardziej szczegółowo wszystkie wiązania i samą strukturę cząsteczki kwasu pikrynowego. Składa się z fenolu z trzema podstawnikami nitrowymi.
Widać, że w grupach NIEdwa atom azotu ma dodatni ładunek cząstkowy i dlatego wymaga gęstości elektronowej otoczenia. Ale pierścień aromatyczny przyciąga również elektrony do siebie, a przed trzema NOdwa kończy się rezygnacją z części własnej gęstości elektronicznej.
W konsekwencji, tlen z grupy OH ma tendencję do dzielenia jednej ze swoich wolnych par elektronowych w celu uzupełnienia deficytu elektronicznego, na który cierpi pierścień; w ten sposób powstaje wiązanie C = O+-H. Ten częściowy dodatni ładunek tlenu osłabia wiązanie O-H i zwiększa kwasowość; to znaczy, zostanie uwolniony jako jon wodorowy, H+.
Kwaśny fenol
Z tego powodu związek ten jest wyjątkowo silnym (i reaktywnym) kwasem, nawet bardziej niż sam kwas octowy. Jednak w rzeczywistości związek ten jest fenolem, którego kwasowość przewyższa kwasowość innych fenoli; z powodu, jak właśnie wspomniano, podstawników NOdwa.
Dlatego, ponieważ jest to fenol, grupa OH ma pierwszeństwo i kieruje wyliczeniem w strukturze. Trzy NIEdwa znajdują się na atomach węgla 2, 4 i 6 pierścienia aromatycznego w odniesieniu do OH. Stąd pochodzi nomenklatura IUPAC dla tego związku: 2,4,6-Trinitrofenol (TNP).
Gdyby nie było grup, NIEdwa, lub gdyby było ich mniej w pierścieniu, wiązanie O-H osłabiłoby się mniej, a zatem związek miałby mniejszą kwasowość.
Struktura krystaliczna
Cząsteczki kwasu pikrynowego są ułożone w taki sposób, że sprzyjają ich interakcjom międzycząsteczkowym; albo do tworzenia wiązań wodorowych między grupami OH i NOdwa, siły dipolowo-dipolowe lub odpychanie elektrostatyczne między regionami z niedoborem elektronów.
Można się spodziewać, że grupy NIE będądwa odpychały się i ustawiały się w kierunku sąsiednich pierścieni aromatycznych. Ponadto pierścienie nie byłyby w stanie ustawić się jeden na drugim ze względu na zwiększone odpychanie elektrostatyczne..
Produkt wszystkich tych interakcji, kwas pikrynowy tworzy trójwymiarową sieć, która definiuje kryształ; którego komórka elementarna odpowiada układowi krystalicznemu typu rombowego.
Synteza
Początkowo był syntetyzowany ze związków naturalnych, m.in. pochodnych rogów zwierzęcych, żywic naturalnych. Od 1841 roku fenol był stosowany jako prekursor kwasu pikrynowego różnymi drogami lub różnymi procedurami chemicznymi.
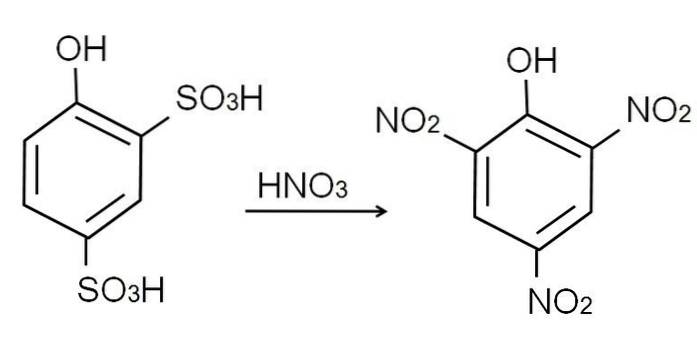
Jak już wspomniano, jest to jeden z najbardziej kwaśnych fenoli. Aby go zsyntetyzować, fenol najpierw poddawany jest procesowi sulfonowania, a następnie procesowi nitrowania..
Sulfonowanie bezwodnego fenolu przeprowadza się przez traktowanie fenolu dymiącym kwasem siarkowym, z wytworzeniem elektrofilowych podstawień aromatycznych H przez grupy sulfonianowe, SO3H, w pozycji -orto i -para w odniesieniu do grupy OH.
Produkt ten, kwas 2,4-fenodisulfonowy, poddawany jest procesowi nitrowania, poddając go działaniu stężonego kwasu azotowego. W ten sposób obie grupy SO3H są zastąpione przez grupy nitrowe, NIEdwa, a trzeci wchodzi na drugą pozycję nitro. Ilustruje to następujące równanie chemiczne:
Bezpośrednie nitrowanie fenolu
Procesu nitrowania fenolu nie można przeprowadzić bezpośrednio, ponieważ powstają smoły o dużej masie cząsteczkowej. Ta metoda syntezy wymaga bardzo dokładnej kontroli temperatury, ponieważ jest bardzo egzotermiczna:
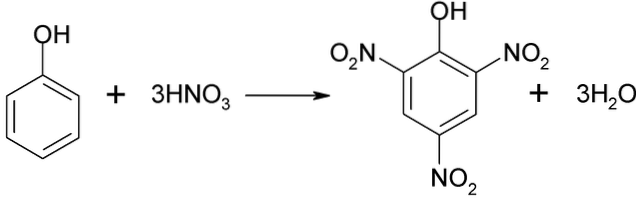
Kwas pikrynowy można otrzymać przeprowadzając proces bezpośredniego nitrowania 2,4-dinitrofenolu kwasem azotowym.
Innym sposobem syntezy jest traktowanie benzenu kwasem azotowym i azotanem rtęci..
Fizyczne i chemiczne właściwości
Waga molekularna
229,104 g / mol.
Wygląd fizyczny
Żółta masa lub zawiesina mokrych kryształów.
Zapach
Jest bezwonny.
Smak
Jest bardzo gorzki.
Temperatura topnienia
122,5 ° C.
Temperatura wrzenia
300 ° C Ale po stopieniu eksploduje.
Gęstość
1,77 g / ml.
Rozpuszczalność
Jest związkiem średnio rozpuszczalnym w wodzie. Dzieje się tak, ponieważ jego grupy OH i NOdwa mogą oddziaływać z cząsteczkami wody poprzez wiązania wodorowe; chociaż pierścień aromatyczny jest hydrofobowy, a zatem pogarsza jego rozpuszczalność.
Korozyjność
Kwas pikrynowy generalnie powoduje korozję metali, z wyjątkiem cyny i aluminium.
pKa
0.38. Jest to mocny kwas organiczny.
Niestabilność
Kwas pikrynowy charakteryzuje się niestabilnymi właściwościami. Stanowi zagrożenie dla środowiska, jest niestabilny, wybuchowy i toksyczny.
Powinien być przechowywany szczelnie zamknięty, aby uniknąć odwodnienia, ponieważ kwas pikrynowy jest bardzo wybuchowy, jeśli zostanie pozostawiony do wyschnięcia. Należy bardzo uważać na jego bezwodną postać, ponieważ jest bardzo wrażliwa na tarcie, wstrząsy i ciepło..
Kwas pikrynowy należy przechowywać w chłodnych, wentylowanych miejscach, z dala od materiałów ulegających utlenieniu. Działa drażniąco w kontakcie ze skórą i błonami śluzowymi, nie należy go połykać, działa toksycznie na organizm.
Aplikacje
Kwas pikrynowy był szeroko stosowany w badaniach, chemii, przemyśle i wojsku..
Dochodzenie
Stosowany jako utrwalacz komórek i tkanek poprawia wyniki barwienia ich barwnikami kwasowymi. Dzieje się tak w przypadku metod barwienia trójchromowego. Po utrwaleniu tkanki formaliną zaleca się nowe utrwalenie kwasem pikrynowym..
W ten sposób zapewniona jest intensywna i bardzo jasna kolorystyka tkanin. Nie można uzyskać dobrych wyników z podstawowymi barwnikami. Należy jednak zachować ostrożność, ponieważ kwas pikrynowy może hydrolizować DNA, jeśli jest pozostawiony zbyt długo..
Chemia organiczna
-W chemii organicznej jest stosowany jako pikryniany alkaliczne do identyfikacji i analizy różnych substancji.
-Znajduje zastosowanie w analitycznej chemii metali.
-W laboratoriach klinicznych jest używany do oznaczania poziomu kreatyniny w surowicy i moczu..
-Został również użyty w niektórych odczynnikach używanych do analizy poziomu glukozy..
W przemyśle
-Na poziomie przemysłu fotograficznego kwas pikrynowy jest stosowany jako sensybilizator w emulsjach fotograficznych. Wchodził w skład produkcji takich produktów, jak między innymi pestycydy, silne środki owadobójcze.
-Kwas pikrynowy jest używany do syntezy innych chemicznych produktów pośrednich, takich jak na przykład chloropikryna i kwas pikramowy. Z tych związków wytworzono niektóre leki i barwniki dla przemysłu skórzanego..
-Kwas pikrynowy zaczął być stosowany w leczeniu oparzeń, jako środek antyseptyczny i inne schorzenia, zanim jego toksyczność stała się ewidentna.
-Ważny składnik ze względu na swój wybuchowy charakter przy produkcji zapałek i baterii.
Zastosowania wojskowe
-Ze względu na wysoką wybuchowość kwasu pikrynowego był stosowany w wytwórniach amunicji do broni wojskowej.
-Sprasowany i stopiony kwas pikrynowy był używany w pociskach artyleryjskich, granatach, bombach i minach.
-Sól amonowa kwasu pikrynowego została użyta jako materiał wybuchowy, jest bardzo silna, ale mniej stabilna niż trotyl. Przez pewien czas był używany jako składnik paliwa rakietowego.
Toksyczność
Udowodniono, że jest bardzo toksyczny dla organizmu ludzkiego i ogólnie dla wszystkich żywych istot.
Zaleca się unikać wdychania i spożycia ze względu na ostrą toksyczność doustną. Powoduje również mutacje w mikroorganizmach. Ma toksyczny wpływ na dzikie zwierzęta, ssaki i ogólnie na środowisko.
Bibliografia
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. Aminy. (10th wydanie.). Wiley plus.
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- Wikipedia. (2018). Kwas pikrynowy. Odzyskane z: en.wikipedia.org
- Uniwersytet Purdue. (2004). Wybuch kwasu pikrynowego. Odzyskany z: chemed.chem.purdue.edu
- Projekt Crystallography 365. (10 lutego 2014). Mniej niż łagodny żółty - struktura kwasu pikrynowego. Odzyskany z: crystallography365.wordpress.com
- PubChem. (2019). Kwas pikrynowy. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Baker, J. R. (1958). Kwas pikrynowy. Methuen, Londyn, Wielka Brytania.



Jeszcze bez komentarzy