
Struktura, właściwości i zastosowanie kwasu nadjodowego (HIO4)

Plik kwas nadjodowy jest to tlenokwas, który odpowiada VII stopniowi utlenienia jodu. Występuje w dwóch formach: ortoperiodycznej (H.5IO6) i kwas metanadjodowy (HIO4). Został odkryty w 1838 roku przez niemieckich chemików H. G. Magnusa i C. F. Ammermüllera.
W rozcieńczonych roztworach wodnych kwas nadjodowy występuje głównie w postaci kwasu metanadjodowego i jonu hydroniowego (H3LUB+). Tymczasem w stężonych roztworach wodnych kwas nadjodowy pojawia się jako kwas ortoperjodowy..

Obie formy kwasu nadjodowego są obecne w dynamicznej równowadze chemicznej, przy czym dominująca postać zależy od pH istniejącego w roztworze wodnym..
Górne zdjęcie przedstawia kwas ortoperiodowy, który składa się z bezbarwnych higroskopijnych kryształów (z tego powodu wyglądają na mokre). Chociaż wzory i struktury między H.5IO6 i HIO4 na pierwszy rzut oka bardzo się różnią, oba są bezpośrednio związane ze stopniem nawodnienia.
H5IO6 można wyrazić jako HIO4∙ 2HdwaLub, a zatem musisz go odwodnić, aby uzyskać HIO4; to samo dzieje się w przeciwnym kierunku, podczas nawadniania HIO4 H jest produkowany5IO6.
Indeks artykułów
- 1 Struktura kwasu nadjodowego
- 1.1 Kwas ortoperojodowy
- 2 Właściwości
- 2.1 Masy cząsteczkowe
- 2.2 Wygląd fizyczny
- 2.3 Temperatura topnienia
- 2.4 Temperatura zapłonu
- 2.5 Stabilność
- 2,6 pH
- 2.7 Reaktywność
- 3 Nazewnictwo
- 3.1 Tradycyjne
- 3.2 Systematyka i stan magazynowy
- 4 Zastosowania
- 4.1 Lekarze
- 4.2 W laboratorium
- 5 Referencje
Struktura kwasu nadjodowego
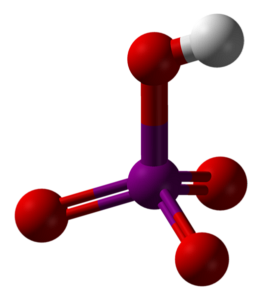
Górny obraz przedstawia strukturę molekularną kwasu metanadjodowego HIO4. Jest to forma, która jest najlepiej wyjaśniona w tekstach z chemii; jednakże jest najmniej stabilna termodynamicznie.
Jak widać, składa się z czworościanu, w środku którego znajduje się atom jodu (fioletowa kula) oraz atomy tlenu (czerwone kule) na jego wierzchołkach. Trzy atomy tlenu tworzą wiązanie podwójne z jodem (I = O), a jeden z nich tworzy wiązanie pojedyncze (I-OH).
Ta cząsteczka jest kwaśna ze względu na obecność grupy OH, która jest w stanie oddać jon H.+; a tym bardziej, gdy dodatni ładunek cząstkowy H jest większy z powodu czterech atomów tlenu związanych z jodem. Zwróć uwagę, że plik HIO4 może tworzyć cztery wiązania wodorowe: jedno poprzez OH (przekazuje) i trzy przez jego atomy tlenu (akceptuje).
Badania krystalograficzne wykazały, że jod może w rzeczywistości przyjmować dwa atomy tlenu z sąsiedniej cząsteczki HIO.4. W ten sposób uzyskuje się dwa ośmiościany IO6, połączone dwoma wiązaniami I-O-I w pozycjach cis; to znaczy, że znajdują się po tej samej stronie i nie są rozdzielone kątem 180 °.
Te ośmiościany IO6 są połączone w taki sposób, że ostatecznie tworzą nieskończone łańcuchy, które podczas interakcji ze sobą „uzbrajają” kryształ HIO4.
Kwas ortoperojodowy
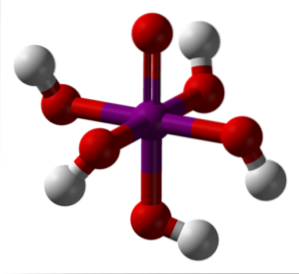
Zdjęcie powyżej przedstawia najbardziej stabilną i uwodnioną formę kwasu nadjodowego: ortoperiodyczny, H.5IO6. Kolorystyka tego modelu prętów i kulek jest taka sama jak dla HIO4 właśnie wyjaśniono. Tutaj możesz bezpośrednio zobaczyć, jak wygląda ośmiościan IO6.
Zauważ, że istnieje pięć grup OH, odpowiadających pięciu jonom H.+ które teoretycznie mogłyby uwolnić cząsteczkę H.5IO6. Jednak ze względu na rosnące odpychanie elektrostatyczne może uwolnić tylko trzy z tych pięciu, ustanawiając różne równowagi dysocjacji..
Te pięć grup OH pozwala na H.5IO6 przyjmuje kilka cząsteczek wody, dlatego jej kryształy są higroskopijne; to znaczy pochłaniają wilgoć obecną w powietrzu. Są one również odpowiedzialne za jego znacznie wysoką temperaturę topnienia dla związku o charakterze kowalencyjnym..
Cząsteczki H.5IO6 tworzą ze sobą wiele wiązań wodorowych i dlatego zapewniają taką kierunkowość, która pozwala również na ułożenie ich w uporządkowanej przestrzeni. W wyniku tego uporządkowania H5IO6 tworzy kryształy jednoskośne.
Nieruchomości
Masy cząsteczkowe
-Kwas metanadjodowy: 190,91 g / mol.
-Kwas ortoperojodowy: 227,941 g / mol.
Wygląd fizyczny
Białe lub jasnożółte ciało stałe do HIO4, lub bezbarwne kryształy, dla H.5IO6.
Temperatura topnienia
128 ° C (263,3 ° F, 401,6 ° F).
Punkt zapłonu
140 ºC.
Stabilność
Stabilny. Silny utleniacz. Kontakt z materiałami palnymi może spowodować pożar. Higroskopijny. Niekompatybilny z materiałami organicznymi i silnymi środkami redukującymi.
pH
1,2 (roztwór 100 g / L wody o temperaturze 20 ºC).
Reaktywność
Kwas nadjodowy jest zdolny do zerwania wiązania wicynalnych dioli obecnych w węglowodanach, glikoproteinach, glikolipidach itp., Tworząc fragmenty cząsteczek z końcowymi grupami aldehydów.
Ta właściwość kwasu nadjodowego służy do określenia struktury węglowodanów, a także obecności substancji pokrewnych tym związkom..
Aldehydy utworzone w tej reakcji mogą reagować z odczynnikiem Schiffa, wykrywając obecność złożonych węglowodanów (stają się fioletowe). Kwas nadjodowy i odczynnik Schiffa są sprzężone z odczynnikiem w skrócie PAS.
Nomenklatura
Tradycyjny
Kwas nadjodowy ma swoją nazwę, ponieważ jod działa z najwyższą ze swoich wartościowości: +7, (VII). Tak nazywa się go według starej nomenklatury (tradycyjnej).
W książkach o chemii zawsze umieszczają HIO4 jako jedyny przedstawiciel kwasu nadjodowego, będący synonimem kwasu metanadjodowego.
Kwas metanadjodowy zawdzięcza swoją nazwę temu, że bezwodnik jodu reaguje z cząsteczką wody; czyli jego stopień nawodnienia jest najniższy:
jadwaLUB7 + H.dwaO => 2HIO4
Podczas gdy do tworzenia kwasu ortoperojodowego, IdwaLUB7 musi reagować z większą ilością wody:
jadwaLUB7 + 5HdwaO => 2H5IO6
Reaguje z pięcioma cząsteczkami wody zamiast jednej.
Termin orto- jest używany wyłącznie w odniesieniu do H.5IO6, i dlatego kwas nadjodowy odnosi się tylko do HIO4.
Systematyka i magazyn
Inne, mniej popularne nazwy kwasu nadjodowego to:
-wodorotetraoksojodan (VII).
-Kwas tetraoksojodowy (VII)
Aplikacje
Lekarze
Fioletowe barwniki PAS otrzymane w reakcji kwasu nadjodowego z węglowodanami są wykorzystywane do potwierdzenia choroby spichrzeniowej glikogenu; na przykład choroba von Gierke.
Stosuje się je w następujących schorzeniach: choroba Pageta, mięsak części miękkiej wzroku, wykrywanie skupisk limfocytów w ziarniniaku grzybiastym i zespole Sezany'ego.
Są również wykorzystywane w badaniach nad erytroleukemią, niedojrzałą białaczką czerwonokrwinkową. Komórki barwią na jasną fuksję. Ponadto w badaniu stosuje się infekcje żywymi grzybami, zabarwiając ściany grzybów na kolor purpurowy.
W laboratorium
-Jest używany do chemicznego oznaczania manganu, oprócz jego wykorzystania w syntezie organicznej.
-Kwas nadjodowy jest stosowany jako utleniacz selektywny w reakcjach chemii organicznej..
-Kwas nadjodowy może powodować uwalnianie aldehydu octowego i wyższych aldehydów. Ponadto kwas nadjodowy może uwalniać formaldehyd do wykrywania i izolacji, jak również uwalnianie amoniaku z hydroksyaminokwasów..
-Roztwory kwasu nadjodowego są wykorzystywane do badania obecności aminokwasów z grupami OH i NH.dwa w sąsiednich pozycjach. Roztwór kwasu nadjodowego stosuje się w połączeniu z węglanem potasu. Pod tym względem seryna jest najprostszym hydroksyaminokwasem.
Bibliografia
- Gavira José M Vallejo. (24 października 2017). Znaczenie przedrostków meta, pyro i orto w starej nomenklaturze. Odzyskany z: triplenlace.com
- Gunawardena G. (17 marca 2016). Kwas nadjodowy. Chemia LibreTexts. Źródło: chem.libretexts.org
- Wikipedia. (2018). Kwas nadjodowy. Odzyskane z: en.wikipedia.org
- Kraft, T. and Jansen, M. (1997), Crystal Structure Determination of Metaperiodic Acid, HIO4, with Combined X-Ray and Neutron Diffraction. Angew. Chem. Int. Ed. Engl., 36: 1753-1754. doi: 10.1002 / anie.199717531
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Martin, A. J. i Synge, R. L. (1941). Wybrane zastosowania kwasu nadjodowego do badań hydroksyaminokwasów hydrolizatów białek: Uwalnianie aldehydu octowego i wyższych aldehydów przez kwas nadjodowy. 2. Wykrywanie i izolacja formaldehydu uwolnionego przez kwas nadjodowy. 3. Rozszczepienie amoniaku z hydroksyaminokwasów przez kwas nadjodowy. 4. Frakcja hydroksyaminokwasowa wełny. 5 .; Hydroksylizyna ”z dodatkiem, Florence O. Bell Textile Physics Laboratory, University of Leeds. Czasopismo Biochemical, 35(3), 294-314,1.
- Asima. Chatterjee i S. G. Majumdar. (1956). Zastosowanie kwasu okresowego do wykrywania i lokalizowania nienasycenia etylenowego. Analytical Chemistry 1956 28 (5), 878-879. DOI: 10.1021 / ac60113a028.



Jeszcze bez komentarzy