
Budowa, właściwości i zastosowanie kwasu jodowodorowego (HI)

Plik kwas jodowodorowy Jest to wodny roztwór jodowodoru charakteryzujący się wysoką kwasowością. Definicja bliższa terminologii chemicznej i terminologii IUPAC mówi, że jest to węglowodór, którego wzór chemiczny to HI.
Jednak aby odróżnić go od cząsteczek gazowego jodowodoru, HI (g) jest oznaczony jako HI (aq). Z tego powodu w równaniach chemicznych ważne jest, aby zidentyfikować ośrodek lub fazę fizyczną, w której znajdują się reagenty i produkty. Mimo to powszechne jest mylenie jodowodoru z kwasem jodowodorowym..
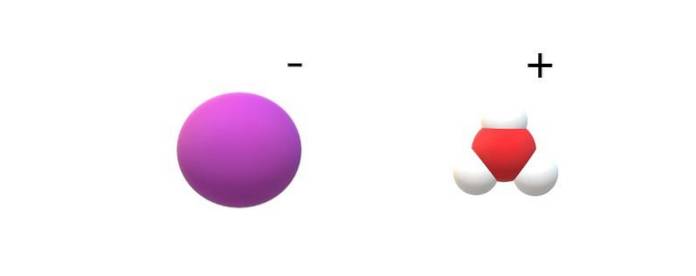
Jeśli zaobserwuje się cząsteczki zaangażowane w ich tożsamość, zauważalne będą różnice między HI (g) i HI (ac). W HI (g) występuje wiązanie H-I; podczas gdy w HI (ac), są one w rzeczywistości parą jonową I.- i H3LUB+ oddziałujące elektrostatycznie (górne zdjęcie).
Z drugiej strony, HI (ac) jest źródłem HI (g), ponieważ pierwszy jest wytwarzany przez rozpuszczenie drugiego w wodzie. Z tego powodu, o ile nie występuje w równaniu chemicznym, HI może być również używany w odniesieniu do kwasu jodowodorowego. HI jest silnym środkiem redukującym i doskonałym źródłem jonów I.- w środowisku wodnym.
Indeks artykułów
- 1 Struktura kwasu jodowodorowego
- 2 Właściwości
- 2.1 Opis fizyczny
- 2.2 Masa cząsteczkowa
- 2.3 Zapach
- 2.4 Gęstość
- 2.5 Temperatura wrzenia
- 2,6 pKa
- 2.7 Kwasowość
- 2.8 Środek redukujący
- 3 Nazewnictwo
- 4 Zastosowania
- 4.1 Źródło jodu w syntezach organicznych i nieorganicznych
- 4.2 Środek redukujący
- 4.3 Proces Cativa
- 4.4 Niedozwolone syntezy
- 5 Referencje
Struktura kwasu jodowodorowego
Kwas jodowodorowy, jak właśnie wyjaśniono, składa się z roztworu HI w wodzie. Będąc w wodzie, cząsteczki HI ulegają całkowitej dysocjacji (silny elektrolit), tworząc jony I.- i H3LUB+. Dysocjację tę można przedstawić za pomocą następującego równania chemicznego:
HI (g) + H.dwaO (l) => I-(ac) + H3LUB+(ac)
Co byłoby równoważne, gdyby zostało zapisane jako:
HI (g) + H.dwaO (l) => HI (ac)
Jednak HI (ac) w ogóle nie ujawnia tego, co stało się z cząsteczkami gazowego HI; wskazuje tylko, że są w środowisku wodnym.
Dlatego prawdziwa struktura HI (ac) składa się z jonów I- i H3LUB+ otoczone cząsteczkami wody, które je nawilżają; im bardziej stężony kwas jodowodorowy, tym mniejsza liczba nieprotonowanych cząsteczek wody.
W rzeczywistości komercyjnie stężenie HI w wodzie wynosi od 48 do 57%; bardziej stężony byłby równoznaczny ze zbyt dymiącym kwasem (a nawet bardziej niebezpiecznym).
Na obrazku widać, że anion I- jest reprezentowana przez fioletową kulę i H.3LUB+ z białymi kulkami i czerwoną, dla atomu tlenu. Kation H.3LUB+ posiada geometrię molekularną piramidy trygonalnej (na zdjęciu z wyższej płaszczyzny).
Nieruchomości
Opis fizyczny
Bezbarwna ciecz; ale może mieć żółtawe i brązowe odcienie, jeśli jest w bezpośrednim kontakcie z tlenem. Dzieje się tak, ponieważ jony ja- utleniać się do jodu cząsteczkowego, I.dwa. Jeśli jest dużo jadwa, jest więcej niż prawdopodobne, że powstaje trójjodkowy anion, I3-, który zabarwia roztwór na brązowo.
Masa cząsteczkowa
127,91 g / mol.
Zapach
Akr.
Gęstość
Gęstość wynosi 1,70 g / ml dla 57% roztworu HI; ponieważ gęstości różnią się w zależności od różnych stężeń HI. W tym stężeniu tworzy się azeotrop (jest destylowany jako pojedyncza substancja, a nie jako mieszanina), którego względna stabilność może wynikać z jego komercjalizacji w stosunku do innych roztworów..
Temperatura wrzenia
Azeotrop o stężeniu 57% HI wrze w temperaturze 127ºC przy ciśnieniu 1,03 bara (PRZEJDŹ DO ATM).
pKa
-1.78.
Kwasowość
Jest to niezwykle mocny kwas do tego stopnia, że powoduje korozję wszystkich metali i tkanin; nawet dla gumy.
Dzieje się tak, ponieważ wiązanie H-I jest bardzo słabe i łatwo pęka podczas jonizacji w wodzie. Ponadto wiązania wodorowe I.- - HOHdwa+ są słabe, więc nie ma nic, co mogłoby kolidować z H.3LUB+ reagować z innymi związkami; to znaczy H3LUB+ był „wolny”, jak I- który nie przyciąga zbyt dużej siły do jego przeciwjonu.
Środek redukujący
HI jest silnym środkiem redukującym, którego głównym produktem reakcji jest I.dwa.
Nomenklatura
Nazewnictwo kwasu jodowodorowego wywodzi się z faktu, że jod „działa” na jednym stopniu utlenienia: -1. A także, ta sama nazwa wskazuje, że ma on wodę w swoim wzorze strukturalnym [I-] [H.3LUB+]. To jedyna nazwa, ponieważ nie jest to czysty związek, ale roztwór.
Aplikacje
Źródło jodu w syntezach organicznych i nieorganicznych
HI jest doskonałym źródłem jonów I.- do syntez nieorganicznych i organicznych, a także jest silnym środkiem redukującym. Na przykład jego 57% wodny roztwór jest używany do syntezy jodków alkilu (takich jak CH3CHdwaI) z alkoholi pierwszorzędowych. Podobnie, grupa OH może być podstawiona za I w strukturze.
Środek redukujący
Kwas jodowodorowy został użyty do redukcji np. Węglowodanów. Jeśli glukoza rozpuszczona w tym kwasie zostanie podgrzana, straci ona wszystkie swoje grupy OH, otrzymując jako produkt węglowodorowy n-heksan..
Zastosowano go również do zredukowania grup funkcjonalnych arkuszy grafenowych w taki sposób, aby można je było sfunkcjonalizować na potrzeby urządzeń elektronicznych..
Cativa Process

Kroki
Proces rozpoczyna się (1) od kompleksu organiczno-irydowego [Ir (CO)dwajadwa]-, geometria płaszczyzny kwadratowej. Ten związek „otrzymuje” jodek metylu, CH3I, produkt zakwaszenia CH3OH z 57% HI. W tej reakcji wytwarzana jest również woda, dzięki której ostatecznie uzyskuje się kwas octowy, pozwalając jednocześnie na odzyskanie HI w ostatnim etapie..
Na tym etapie zarówno grupa -CH3 podobnie jak -I wiążą się z centrum metalicznego irydu (2), tworząc oktaedryczny kompleks z fasetką złożoną z trzech ligandów I. Jeden z jodów zostaje zastąpiony cząsteczką tlenku węgla CO; a teraz (3), oktaedryczny kompleks ma aspekt złożony z trzech ligandów CO.
Następnie następuje przegrupowanie: grupa -CH3 „rozluźnia się” od Ir i wiąże się z sąsiednim CO (4), tworząc grupę acetylową, -COCH3. Ta grupa jest uwalniana z kompleksu irydu, aby związać się z jonami jodkowymi i dać CH3COI, jodek acetylu. Tutaj odzyskuje się katalizator irydowy, gotowy do udziału w innym cyklu katalitycznym.
Wreszcie CH3MKOl przechodzi wymianę I- na jedną cząsteczkę H.dwaO, którego mechanizm kończy się uwalnianiem HI i kwasu octowego.
Niedozwolone syntezy

Można zauważyć, że podstawienie grupy OH za I następuje najpierw, a następnie drugie podstawienie za H.
Bibliografia
- Wikipedia. (2019). Kwas jodowodorowy. Odzyskane z: en.wikipedia.org
- Andrews, Natalie. (24 kwietnia 2017). Zastosowania kwasu jodowodorowego. Nauka. Odzyskany z: sciencing.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Kwas jodowodorowy. Pobrane z: alfa.com
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Kwas jodowodorowy. Baza danych PubChem., CID = 24841. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Steven A. Hardinger. (2017). Ilustrowany słownik chemii organicznej: kwas jodowodorowy. Odzyskany z: chem.ucla.edu
- Reusch William. (5 maja 2013). Węglowodany. Odzyskane z: 2.chemistry.msu.edu
- W Kyu Moon, Junghyun Lee, Rodney S. Ruoff i Hyoyoung Lee. (2010). Zredukowany tlenek grafenu przez grafityzację chemiczną. DOI: 10.1038 / ncomms1067.


Jeszcze bez komentarzy