
Budowa, funkcje, właściwości, synteza cytozyny
Plik cytozyna Jest to zasada azotowa typu pirymidyny, która jest używana do biosyntezy cytydyno-5'-monofosforanu i deoksycytydyno-5'-monofosforanu. Związki te służą odpowiednio do biosyntezy kwasu dezoksyrybonukleinowego (DNA) i kwasu rybonukleinowego (RNA). DNA przechowuje informacje genetyczne, a RNA pełni różne funkcje.
W organizmach żywych cytozyna nie występuje w postaci wolnej, ale zwykle tworzy rybonukleotydy lub dezoksyrybonukleotydy. Oba typy związków mają grupę fosforanową, rybozę i zasadę azotową..
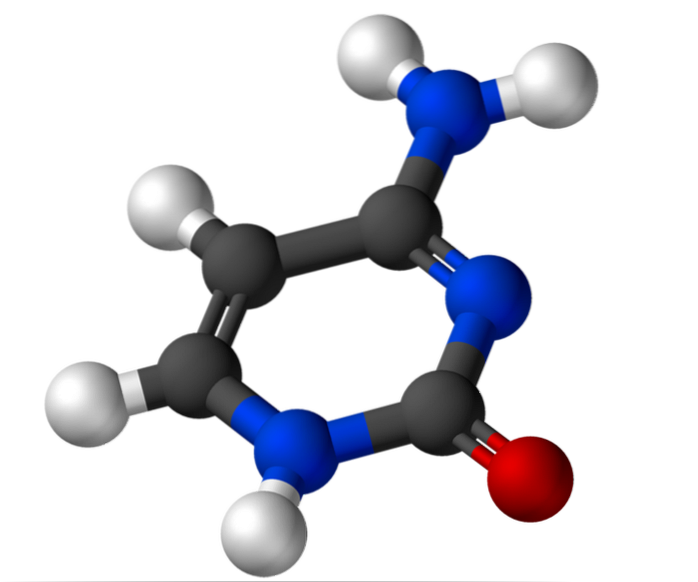
Węgiel 2 rybozy ma grupę hydroksylową (-OH) na rybonukleotydach i atom wodoru (-H) na dezoksyrybonukleotydach. W zależności od liczby obecnych grup fosforanowych występuje cytydyno-5'-monofosforan (CMP), cytydyno-5'-difosforan (CDP) i cytydyno-5'-trifosforan (CTP).
Odtlenione odpowiedniki nazywane są deoksycytydyno-5'-monofosforanem (dCMP), deoksycytydyno-5'-difosforanem (dCDP) i deoksycytydyno-5'-trifosforanem (dCTP)..
Cytozyna w jej różnych formach uczestniczy w różnych funkcjach, takich jak biosynteza DNA i RNA, biosynteza glikoprotein i regulacja ekspresji genów..
Indeks artykułów
- 1 Struktura i właściwości
- 2 Biosynteza
- 2.1 Regulacja biosyntezy
- 2.2 Pirymidyny, podobnie jak cytozyna, są poddawane recyklingowi
- 3 Rola w biosyntezie DNA
- 4 Rola w stabilizacji struktury DNA
- 5 Rola regionów bogatych w cytozynę w DNA
- 6 Rola w biosyntezie RNA
- 7 Rola w biosyntezie glikoprotein
- 8 Chemioterapeutyczne metody leczenia cytozyną i raka
- 9 Odniesienia
Struktura i właściwości
Cytozyna, 4-amino-2-hydroksypirymidyna, ma wzór empiryczny C4H.5N3O, którego masa cząsteczkowa wynosi 111,10 g / mol i jest oczyszczana jako biały proszek.
Struktura cytozyny to planarny aromatyczny pierścień heterocykliczny. Długość fali maksymalnej absorbancji (ʎmax) ma 260 nm. Temperatura topnienia cytozyny przekracza 300 ° C.
Aby utworzyć nukleotyd, cytozyna jest kowalencyjnie przyłączona, poprzez azot 1, poprzez wiązanie N-beta-glikozydowe do węgla 1 'rybozy. Węgiel 5 'jest estryfikowany grupą fosforanową.
Biosynteza
Biosynteza nukleotydów pirymidynowych ma wspólną ścieżkę, składającą się z sześciu etapów katalizowanych enzymatycznie. Szlak rozpoczyna się od biosyntezy fosforanu karbamoilu. U prokariotów występuje tylko jeden enzym: syntaza fosforanu karbamoilu. Odpowiada za syntezę pirymidyn i glutaminy. U eukariontów istnieją syntazy karbamoilofosforanowe I i II, które są odpowiedzialne odpowiednio za biosyntezę glutaminy i pirymidyn.
Drugi etap polega na tworzeniu N-karbamoiloasparaginianu z fosforanu karboilu i asparaginianu, reakcji katalizowanej przez transkabamoilazę asparaginianową (ATCase).
Trzeci etap to synteza L-dihydrorotanu, który powoduje zamknięcie pierścienia pirymidynowego. Ten etap jest katalizowany przez dihydrootazę..
Czwartym etapem jest tworzenie orotanu, który jest reakcją redoks katalizowaną przez dehydrogenazę dihydroorotanu..
Piąty etap obejmuje tworzenie orotydylanu (OMP) przy użyciu pirofosforanu fosforybozylu (PRPP) jako substratu i transferazy fosforibozylowej orotanu jako katalizatora..
Szósty etap to tworzenie urydylanu (urydyno-5'-monofosforan, UMP), reakcja katalizowana przez dekarboksylazę OMP..
Kolejne etapy obejmują fosforylację UMP, katalizowaną przez kinazy, w celu utworzenia UTP oraz przeniesienie grupy aminowej z glutaminy do UTP w celu utworzenia CTP, reakcja katalizowana przez syntetazę CTP..
Regulacja biosyntezy
U ssaków regulacja zachodzi na poziomie syntazy karbamoilofosforanowej II, enzymu występującego w cytozolu, podczas gdy syntaza karbamoilofosforanowa I jest mitochondrialna..
Syntaza karbamoilofosforanowa II jest regulowana przez ujemne sprzężenie zwrotne. Jego regulatory, UTP i PRPP, są odpowiednio inhibitorem i aktywatorem tego enzymu.
W tkankach pozawątrobowych jedynym źródłem fosforanu karbamoilu jest syntaza karbamoilofosforanowa II. W wątrobie, w warunkach nadmiaru amoniaku, syntaza karbamoilofosforanu I wytwarza w mitochondriach fosforan karbamoilu, który jest transportowany do cytozolu, skąd trafia na szlak biosyntezy pirymidyny..
Innym punktem regulacji jest dekarboksylaza OMP, która jest regulowana przez konkurencyjne hamowanie. Jego produkt reakcji, UMP, konkuruje z OMP o miejsce wiązania dekarboksylazy OMP..
Pirymidyny, podobnie jak cytozyna, są poddawane recyklingowi
Recykling pirymidyn ma na celu ponowne wykorzystanie pirymidyn bez potrzeby biosyntezy de novo i unikania szlaku degradacji. Reakcja zawracania jest katalizowana przez fosforybozylotransferazę pirymidynową. Ogólna reakcja jest następująca:
Pirymidyna + PRPP -> nukleozyd pirymidynowy 5'-monofosforan + PPi
U kręgowców fosforybozylotransferaza pirymidynowa znajduje się w erytrocytach. Substratami pirymidynowymi dla tego enzymu są uracyl, tymina i orotan. Cytozyna jest pośrednio zawracana z urydyno-5'-monofosforanu.
Rola w biosyntezie DNA
Podczas replikacji DNA informacja zawarta w DNA jest kopiowana do DNA przez polimerazę DNA..
Biosynteza RNA wymaga trifosforanu deoksynukleotydu (dNTP), a mianowicie: trifosforanu deoksytymidyny (dTTP), trifosforanu deoksycytydyny (dCTP), trifosforanu deoksyadeniny (dATP) i trifosforanu deoksyguaniny (dGTP). Reakcja jest następująca:
(DNA)n pozostałości + dNTP -> (DNA)n + 1 pozostałość + PPi
Hydroliza nieorganicznego pirofosforanu (PPi) dostarcza energii do biosyntezy RNA.
Rola w stabilizacji struktury DNA
W podwójnej helisie DNA jednoniciowa puryna jest połączona z przeciwną nicią pirymidyny wiązaniami wodorowymi. Zatem cytozyna jest zawsze połączona z guaniną trzema wiązaniami wodorowymi: adenina jest połączona z tyminą dwoma wiązaniami wodorowymi..
Wiązania wodorowe są przerywane, gdy roztwór oczyszczonego natywnego DNA o pH 7 zostanie poddany działaniu temperatury powyżej 80 ° C. To powoduje, że podwójna helisa DNA tworzy dwie oddzielne nici. Ten proces jest nazywany denaturacją..
Temperatura, w której 50% DNA ulega denaturacji, nazywana jest temperaturą topnienia (Tm). Cząsteczki DNA, których stosunek guaniny i cytozyny jest wyższy niż tyminy i adeniny, mają wyższe wartości Tm niż te, których stosunek zasad jest odwrotny.
Opisane powyżej stanowi eksperymentalny dowód na to, że większa liczba wiązań wodorowych lepiej stabilizuje natywne cząsteczki DNA..
Rola regionów bogatych w cytozynę w DNA
Niedawno odkryto, że DNA z jądra komórek ludzkich może przyjmować struktury motywów rozproszonych (iM). Struktury te występują w regionach bogatych w cytozynę.
Struktura iM składa się z czterech nici DNA, w przeciwieństwie do klasycznego dwuniciowego DNA, który ma dwie nici. Dokładniej, dwa równoległe łańcuchy dupleksowe są przeplatane w orientacji przeciwrównoległej i są utrzymywane razem przez parę hemiprotonowanych cytozyn (C: C+).
W genomie ludzkim struktury iM znajdują się w takich regionach, jak promotory i telomery. Liczba struktur iM jest wyższa w fazie G1 / S cyklu komórkowego, w którym transkrypcja jest wysoka. Regiony te są miejscami rozpoznawania białek zaangażowanymi w aktywację mechanizmu transkrypcyjnego..
Z drugiej strony, w regionach bogatych w kolejne pary zasad guaniny (C), DNA ma tendencję do przyjmowania kształtu A-helisy w warunkach odwodnienia. Ten kształt jest typowy dla podwójnych prążków RNA i mieszanych DNA-RNA podczas transkrypcji i replikacji oraz w pewnych momentach, gdy DNA jest wiązane z białkami..
Wykazano, że kolejne regiony zasad cytozyny tworzą elektrododatni obszar w głównej szczelinie DNA. Dlatego uważa się, że te regiony wiążą się z białkami, predysponując pewne regiony genomowe do kruchości genetycznej..
Rola w biosyntezie RNA
Podczas transkrypcji informacje zawarte w DNA są kopiowane do RNA przez polimerazę RNA. Biosynteza RNA wymaga trifosforanu nukleozydu (NTP), a mianowicie: trifosforanu cytydyny (CTP), trifosforanu urydyny (UTP), trifosforanu adeniny (ATP) i trifosforanu guaniny (GTP). Reakcja jest następująca:
(RNA)n pozostałości + NTP -> (RNA)n + 1 pozostałość + PPi
Hydroliza nieorganicznego pirofosforanu (PPi) dostarcza energii do biosyntezy RNA.
Rola w biosyntezie glikoprotein
Sekwencyjne przenoszenie heksoz w celu utworzenia oligosacharydów, O-połączonych z białkami, zachodzi z prekursorów nukleotydów.
U kręgowców ostatni etap biosyntezy O-połączonych oligosacharydów polega na dodaniu dwóch reszt kwasu sialowego (N-acetyloneuraminowego) z prekursora cytydyno-5'-monofosforanu (CMP). Ta reakcja zachodzi w worku Golgiego trans.
Zabiegi chemioterapeutyczne cytozyną i nowotworową
Kwas tetrahydrofolianowy (FH4) jest źródłem grup -CH3, i jest niezbędny do biosyntezy dTMP z dUMP. Ponadto powstaje FH2. Redukcja FH2 do FH4 wymaga reduktazy kwasu foliowego i NADPH. Niektóre inhibitory reduktazy kwasu foliowego, takie jak aminopteryna i metotreksat, są stosowane w leczeniu raka.
Metotreksan jest konkurencyjnym inhibitorem. Reduktaza folianowa wiąże się z tym inhibitorem ze 100-krotnie większym powinowactwem niż z jego substratem. Aminopterin działa w podobny sposób.
Hamowanie reduktazy folianowej pośrednio utrudnia biosyntezę dTMP, a tym samym dCTP. Bezpośrednie hamowanie zachodzi przez inhibitory enzymu syntetazy tymidylanowej, który katalizuje dTMP z dUMP. Te inhibitory to 5-fluorouracyl i 5-fluoro-2-dezoksyurydyna..
Na przykład 5-fluoroacyl nie jest sam w sobie inhibitorem, ale najpierw przekształca się w szlaku recyklingu do dezoksyurydyny mphosforan d (FdUMP), który wiąże i hamuje syntetazę tymidylanową..
Substancje analogiczne do glutaminy, azaseryny i acywicyny hamują amidotransferazę glutaminy. Azarin był jedną z pierwszych odkrytych substancji, które działają jak dezaktywator samobójstwa.
Bibliografia
- Assi, H.A., Garavís, M., González, C. i Damha, M.J. 2018. DNA i-Motif: cechy strukturalne i znaczenie dla biologii komórki. Nuclei Acids Research, 46: 8038–8056.
- Bohinski, R. 1991. Biochemistry. Addison-Wesley Iberoamericana, Wilmington, Delaware.
- Devlin, T.M. 2000. Biochemistry. Od redakcji Reverté, Barcelona.
- Lodish, H., Berk, A., Zipurski, S.L., Matsudaria, P., Baltimore, D., Darnell, J. 2003. Cellular and Molecular biology. Od redakcji Medica Panamericana, Buenos Aires, Bogota, Caracas, Madryt, Meksyk, Sāo Paulo.
- Nelson, D. L., Cox, M. M. 2008. Lehninger-Principles of biochemistry. W.H. Freeman, Nowy Jork.
- Voet, D. i Voet, J. 2004. Biochemistry. John Wiley and Sons, USA.


Jeszcze bez komentarzy