
Wzór chloru gazowego, skutki, zastosowania i zagrożenia
Plik gaz chlorowy (dichlorek, chlor dwuatomowy, chlor cząsteczkowy lub po prostu chlor) to zielonkawo-żółty gaz o ostrym i duszącym zapachu, niepalny w temperaturze pokojowej i pod ciśnieniem atmosferycznym.
Jest to pierwiastek o najwyższym powinowactwie elektronowym i trzecią pod względem elektroujemności, zaraz za tlenem i fluorem. Jest niezwykle reaktywny i silnie utleniający.
Wysoki potencjał utleniający chloru pierwiastkowego doprowadził do opracowania komercyjnych wybielaczy i środków dezynfekujących, a także odczynnika do wielu procesów w przemyśle chemicznym..
W postaci jonów chlorkowych chlor jest niezbędny dla wszystkich znanych gatunków życia. Ale pierwiastkowy chlor w wysokich stężeniach jest niezwykle niebezpieczny i trujący dla wszystkich żywych organizmów, dlatego został użyty podczas I wojny światowej jako pierwszy gazowy chemiczny środek bojowy..

Działa toksycznie przez drogi oddechowe. Długotrwałe wdychanie niskich stężeń lub krótkotrwałe wdychanie wysokich stężeń chloru gazowego ma szkodliwy wpływ na zdrowie..
Opary są znacznie cięższe od powietrza i mają tendencję do osadzania się w nisko położonych obszarach. Nie pali się, ale wspomaga spalanie. Jest słabo rozpuszczalny w wodzie. Kontakt z nieskrępowanymi cieczami może spowodować odmrożenia w wyniku chłodzenia przez parowanie.
Służy do oczyszczania wody, wybielania miazgi drzewnej i wytwarzania innych chemikaliów.
Indeks artykułów
- 1 Formuła
- 2 Konstrukcja 2D
- 3 Funkcje
- 3.1 Właściwości fizyczne i chemiczne
- 3.2 Alerty reaktywności
- 3.3 Palność
- 3.4 Reaktywność
- 3.5 Toksyczność
- 4 Zastosowania
- 5 Efekty kliniczne
- 6 Bezpieczeństwo i zagrożenia
- 6.1 Klasy zagrożenia GHS
- 6.2 Kody zwrotów wskazujących środki ostrożności
- 7 Referencje
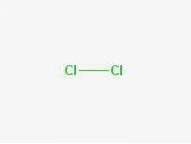
Formuła
Formuła: Cl-Cl
numer CAS: 7782-50-5
Struktura 2D

Charakterystyka
Fizyczne i chemiczne właściwości

Chlor należy do reaktywnej grupy silnych utleniaczy. Związki te często silnie reagują z innymi związkami..
Chlor należy również do reaktywnej grupy silnych środków halogenujących, które przenoszą jeden lub więcej atomów chlorowca na związek, z którym reagują..
Środki halogenujące są na ogół kwaśne i dlatego reagują, w niektórych przypadkach gwałtownie, z zasadami.
Wiele z tych związków reaguje z wodą i z powietrzem. Halogeny są silnie elektroujemnymi i silnymi utleniaczami.
Alerty reaktywności
Chlor jest silnym utleniaczem. Reaguje z wodą. Woda rozpuszcza gazowy chlor, tworząc mieszaninę kwasu solnego i kwasu podchlorawego.
Zapalność
Może zapalić inne palne materiały (drewno, papier, olej itp.). Mieszanie z paliwami może spowodować wybuch. Pojemnik może wybuchnąć w kontakcie z ogniem. Istnieje ryzyko wybuchu (i zatrucia) w wyniku gromadzenia się jego oparów w pomieszczeniach, w kanałach ściekowych lub na zewnątrz..
Mieszaniny wodoru i chloru (5-95%) mogą eksplodować pod działaniem prawie każdej formy energii (ciepło, światło słoneczne, iskry itp.).
Po podgrzaniu wydziela silnie toksyczne opary. W połączeniu z wodą lub parą tworzy toksyczne i żrące opary kwasu solnego.
Reaktywność
Chlor reaguje wybuchowo z wieloma popularnymi materiałami (lub wspomaga ich spalanie).
- Chlor powoduje zapłon stali w temperaturze 100 ° C w obecności sadzy, tlenku, węgla lub innych katalizatorów.
- Włącz suchą wełnę stalową w temperaturze 50 ° C.
- Zapal siarczki w temperaturze pokojowej.
- Zapala (w postaci płynnej) kauczuk naturalny i syntetyczny.
- Zapala trialkiloborany i dwutlenek wolframu.
- Zapala się w kontakcie z hydrazyną, hydroksyloaminą i azotkiem wapnia.
- Zapala się lub eksploduje arsynem, fosfinem, silanem, diboranem, stybiną, czerwonym fosforem, białym fosforem, borem, aktywnym węglem, krzemem, arsenem.
- Powoduje zapłon i miękką eksplozję podczas bulgotania przez zimny metanol.
- Wybucha lub zapala się w przypadku nadmiernego zmieszania z amoniakiem i podgrzania.
- Tworzy wybuchowy trichlorek azotu w kontakcie z Odczynnikiem Biuret zanieczyszczonym kwasem cyjanurowym.
- Z azyrydyną łatwo tworzy wybuchowe pochodne N-chloru.
Chlor (w postaci ciekłej lub gazowej) reaguje z:
- Alkohole (wybuch)
- Stopione aluminium (wybuch)
- Silany (wybuch)
- Pentafluorek bromu
- Dwusiarczek węgla (wybuch katalizowany żelazem)
- Chlor-2-propyn (nadmiar chloru powoduje wybuch)
- Ftalan dibutylu (Wybuch w 118 ° C)
- Eter dietylowy (świeci)
- Cynk dietylowy (świeci)
- Glicerol (wybuch przy 70-80 ° C)
- Metan na żółtym tlenku rtęci (wybuch)
- Acetylen (wybuch zainicjowany przez światło słoneczne lub ogrzewanie)
- Etylen na rtęci, tlenek rtęci (I) lub tlenek srebra (I) (eksplozja spowodowana ciepłem lub światłem)
- Benzyna (reakcja egzotermiczna, a następnie detonacja)
- Mieszanina benzyny i wodorotlenku sodu (gwałtowna eksplozja)
- Chlorek cynku (reakcja egzotermiczna)
- Wosk (podmuch)
- Wodór (wybuch zainicjowany przez światło)
- Węglik żelaza
- Uran i cyrkon
- Wodorki sodu, potasu i miedzi
- Cyna
- Proszek aluminiowy
- Proszek wanadu
- Folia aluminiowa
- Blichtr
- Folia miedziana
- Proszek wapniowy
- Drut żelazny
- Proszek manganu
- Potas
- Proszek antymonu
- Bizmut
- German
- Magnez
- Sód
- Cynk
Toksyczność
Chlor jest trujący i może być śmiertelny w przypadku wdychania. Kontakt może spowodować oparzenia skóry i oczu, a także zapalenie oskrzeli lub przewlekłe choroby płuc..

Aplikacje
Obecnie w handlu stosuje się około 15 000 związków chloru. Chlorek sodu jest zdecydowanie najpowszechniejszym związkiem chloru i głównym źródłem chloru i kwasu solnego w ogromnym przemyśle chemicznym chloru..
Z całego wyprodukowanego chloru pierwiastkowego około 63% jest wykorzystywane do produkcji związków organicznych, 18% do produkcji nieorganicznych związków chloru, a pozostałe 19% do produkcji wybielaczy i środków dezynfekujących..

Do najważniejszych związków organicznych pod względem wielkości produkcji należą między innymi 1,2-dichloroetan i chlorek winylu (półprodukty w produkcji PCW), chlorek metylu, chlorek metylenu, chloroform, chlorek winylidenu..
Główne związki nieorganiczne to HCl, Cl2O, HOCl, NaClO3, AlCl3, SiCl4, SnCl4, PCl3, PCl5, POCl3, AsCl3, SbCl3, SbCl5, BiCl3, S2Cl2, SCl2, SOCI2, ClF3, ICl, ICl3, MoCl3, TiCl3, , ZnCl2 i wiele innych.
Chlor gazowy jest używany w przemysłowych operacjach bielenia, oczyszczaniu ścieków, produkcji tabletek do chlorowania basenów lub w walce chemicznej.
Chlor (znany jako bertholit) został po raz pierwszy użyty jako broń w I wojnie światowej przez Niemcy.
Po jego pierwszym użyciu obie strony konfliktu użyły chloru jako broni chemicznej, ale wkrótce został on zastąpiony bardziej śmiercionośnym fosgenem i gazem musztardowym..
Chlor gazowy był również używany podczas wojny w Iraku w prowincji Anbar w 2007 roku.
Efekty kliniczne
Chlor gazowy jest jednym z najczęściej występujących w środowisku zawodowym i środowiskowym pojedynczej inhalacji narażonej na podrażnienia. Ostatnie badania wykazały, że mieszanina wybielacza (wybielacza, wytwarzanego głównie na bazie podchlorynu sodu) z innymi środkami czyszczącymi jest najczęstszą przyczyną (21% przypadków) jednorazowego narażenia inhalacyjnego zgłaszaną w ośrodkach kontroli zatruć. Ze Stanów Zjednoczonych..
Główne skutki toksyczne wynikają raczej z miejscowego uszkodzenia tkanki niż ogólnoustrojowego wchłaniania. Uważa się, że uszkodzenie komórek jest wynikiem utleniania grup funkcyjnych na składnikach komórkowych; na reakcje z wodą w tkankach z wytworzeniem kwasu podchlorawego i kwasu solnego; i generowanie wolnych rodników tlenowych (chociaż ten pomysł jest obecnie kontrowersyjny).
W przypadku od łagodnego do umiarkowanego zatrucia występują: kaszel, duszność, ból w klatce piersiowej, uczucie pieczenia w gardle i okolicy zamostkowej, nudności lub wymioty, podrażnienie oczu i nosa, duszenie się, osłabienie mięśni, zawroty głowy, dyskomfort w jamie brzusznej i ból głowy.
W przypadku ciężkiego zatrucia występuje: obrzęk górnych dróg oddechowych, skurcz krtani, ciężki obrzęk płuc, zapalenie płuc, utrzymująca się hipoksemia, niewydolność oddechowa, ostry uraz płuc, kwasica metaboliczna.
Przewlekła ekspozycja na chlor gazowy jest jedną z najczęstszych przyczyn astmy zawodowej. Może powodować duszność, kołatanie serca, ból w klatce piersiowej, zespół reaktywnej dysfunkcji górnych dróg oddechowych, erozję szkliwa zębów i zwiększoną częstość występowania zespołów wirusowych. Przewlekła ekspozycja na 15 ppm powoduje kaszel, krwioplucie, ból w klatce piersiowej i ból gardła.
Kontakt ze skórą może powodować rumień, ból, podrażnienie i oparzenia skóry. Poważne narażenie może spowodować zapaść sercowo-naczyniową i zatrzymanie oddychania. W wysokich stężeniach mogą wystąpić omdlenia i prawie natychmiastowa śmierć. Chlor (jako podchloryn) ma działanie teratogenne u zwierząt doświadczalnych.
Bezpieczeństwo i ryzyko
Zwroty wskazujące rodzaj zagrożenia Globalnie Zharmonizowanego Systemu Klasyfikacji i Oznakowania Chemikaliów (GHS).
Globalnie Zharmonizowany System Klasyfikacji i Oznakowania Chemikaliów (GHS) to system uzgodniony na szczeblu międzynarodowym, stworzony przez ONZ, mający na celu zastąpienie różnych norm klasyfikacji i oznakowania stosowanych w różnych krajach poprzez stosowanie spójnych kryteriów na poziomie globalnym (ONZ, 2015 ).
Klasy zagrożenia (i odpowiadający im rozdział GHS), normy klasyfikacji i oznakowania oraz zalecenia dotyczące chloru gazowego są następujące (Europejska Agencja Chemikaliów, 2017; Organizacja Narodów Zjednoczonych, 2015; PubChem, 2017):
Klasy zagrożenia GHS
H270: Może spowodować lub intensyfikować pożar; Utleniacz [Niebezpieczeństwo Gazy utleniające - Kategoria 1]
H280: Zawiera gaz pod ciśnieniem; Może wybuchnąć po podgrzaniu [Gazy ostrzegawcze pod ciśnieniem - gaz sprężony, gaz skroplony, gaz rozpuszczony]
H315: Działa drażniąco na skórę [Uwaga Działanie żrące / drażniące na skórę - Kategoria 2]
H319: Działa drażniąco na oczy [Uwaga Poważne uszkodzenie oczu / działanie drażniące na oczy - Kategoria 2A]
H330: Wdychanie grozi śmiercią [Zagrożenie Toksyczność ostra, inhalacja - Kategoria 1, 2]
H331: Działa toksycznie przez drogi oddechowe [Zagrożenie Toksyczność ostra, przez drogi oddechowe - Kategoria 3]
H335: Może powodować podrażnienie dróg oddechowych [Uwaga Działanie toksyczne na narządy docelowe, jednorazowe narażenie; Podrażnienie dróg oddechowych - kategoria 3]
H400: Działa bardzo toksycznie na organizmy wodne [Uwaga Stwarzające zagrożenie dla środowiska wodnego, zagrożenie ostre - kategoria 1]
H410: Działa bardzo toksycznie na organizmy wodne, powodując długotrwałe skutki [Uwaga: Stwarzające zagrożenie dla środowiska wodnego, zagrożenie długotrwałe - Kategoria 1]
(PubChem, 2017)
Kody zwrotów wskazujących środki ostrożności
P220, P244, P260, P261, P264, P271, P273, P280, P284, P302 + P352, P304 + P340, P305 + P351 + P338, P310, P311, P312, P320, P321, P332 + P313, P337 + P313, P362, P370 + P376, P391, P403, P403 + P233, P405, P410 + P403 i P501.
Bibliografia
- Benjah-bmm27 (2007). Dichlorine-gas-3D-vdW [obraz]. Odzyskany z: commons.wikimedia.org.
- Bundesarchiv (1915). Deutsche Soldaten versprühen künstlichen Nebel [zdjęcie]. Odzyskany z: commons.wikimedia.org.
- ChemIDplus (2017) Struktura 3D 7782-50-5 - Chlor [zdjęcie] Odzyskane z: chem.nlm.nih.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Arkusz danych grupy reaktywnej. Utleniacze, Silne. Silver Spring, MD. UE; Odzyskany z: cameochemicals.noaa.gov.
- Oelen, W., (2005). Chlor gazowy w butli [zdjęcie]. Odzyskany z: commons.wikimedia.org.
- Sargent, J. (1918). Zagazowane [zdjęcie]. Odzyskane z: en.wikipedia.org.
- Tomia (2006). Plastik-recykling-03 [zdjęcie]. Odzyskany z: commons.wikimedia.org.
- Wikipedia (2017). Chlor. Odzyskane z: en.wikipedia.org.



Jeszcze bez komentarzy