
Budowa konfiguracji jądra elektronicznego, przykłady
Plik konfiguracja jądra elektronu lub zwarty to taki, którego notacje kwantowe liczby elektronów i ich podpoziomów energii są skrócone przez symbole gazu szlachetnego w nawiasach. Jest to bardzo przydatne podczas pisania konfiguracji elektronicznych dla danego elementu, ponieważ jest proste i szybkie.
Słowo „jądro” zwykle odnosi się do wewnętrznych powłok elektronicznych atomu; to znaczy takie, w których ich elektrony nie mają wartościowości i dlatego nie uczestniczą w wiązaniu chemicznym, chociaż definiują właściwości pierwiastka. Mówiąc metaforycznie, jądro byłoby wnętrzem cebuli, z jej warstwami złożonymi z szeregu orbitali zwiększających energię.
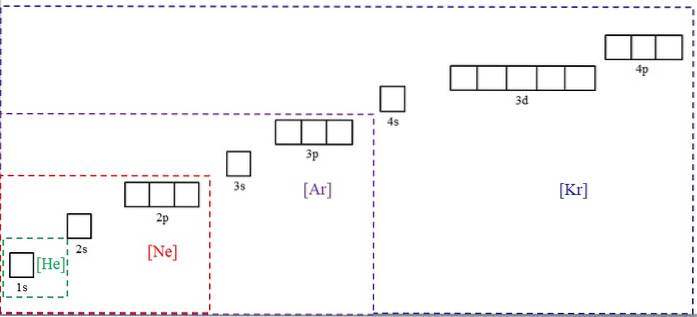
Powyższy obrazek przedstawia symbole chemiczne czterech gazów szlachetnych w nawiasach i w różnych kolorach: [He] (zielony), [Ne] (czerwony), [Ar] (fioletowy) i [Kr] (niebieski).
Każda z jego kropkowanych ramek zawiera pola, które reprezentują orbitale. Im są większe, tym więcej zawierają elektronów; co z kolei będzie oznaczać, że konfiguracje elektroniczne większej liczby elementów można uprościć za pomocą tych symboli. Oszczędza to czas i energię przy zapisywaniu wszystkich notacji.
Indeks artykułów
- 1 Porządek budowy
- 2 Skrót oznaczający konfigurację elektronów
- 3 przykłady
- 3.1 Ogólne
- 3.2 Tlen
- 3.3 Potas
- 3.4 Indian
- 3.5 Wolfram
- 4 Odnośniki
Buduj porządek
Przed użyciem konfiguracji jądra elektronicznego warto przejrzeć prawidłową kolejność tworzenia lub zapisywania tych konfiguracji. Kieruje się to zasadą przekątnych lub diagramem Moellera (zwanym w niektórych częściach metodą deszczową). Mając ten diagram pod ręką, notacje kwantowe są następujące:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Ten ciąg notacji kwantowych wygląda na męczący; a byłoby jeszcze bardziej, gdyby musiało być zapisywane za każdym razem, gdy ma być reprezentowana konfiguracja elektronowa dowolnego elementu znalezionego w okresie 5 i następnych. Zauważ również, że struna jest pozbawiona elektronów; nie ma liczb w górnym prawym kącie (1sdwa2sdwa2 P6…).
Należy pamiętać, że orbitale s może „pomieścić” dwa elektrony (nsdwa). Orbitale p są w sumie trzy (spójrz na trzy pola powyżej), więc mogą pomieścić sześć elektronów (np6). I wreszcie orbitale re jest pięć, a fa siedem, mając w sumie dziesięć (nd10) i czternastu (nf14) elektrony.
Skrót oznaczający konfigurację elektronów
Powiedziawszy powyższe, przystępujemy do wypełniania poprzedniego rzędu notacji kwantowych elektronami:
1sdwa 2sdwa 2 P6 3sdwa 3p6 4sdwa 3d10 4p6 5sdwa 4d10 5 pkt6 6sdwa 4f14 5 d10 6p6 7sdwa 5f14 6d10 7p6
Ile elektronów jest we wszystkich? 118. A któremu pierwiastkowi odpowiada tak ogromna liczba elektronów w jego atomie? Oganesonowi gazu szlachetnego, Og.
Załóżmy, że istnieje pierwiastek o liczbie kwantowej Z równej 119. Wtedy jego konfiguracja elektronów walencyjnych wynosiłaby 8s1; ale jaka byłaby jego pełna konfiguracja elektroniczna?
1sdwa 2sdwa 2 P6 3sdwa 3p6 4sdwa 3d10 4p6 5sdwa 4d10 5 pkt6 6sdwa 4f14 5 d10 6p6 7sdwa 5f14 6d10 7p6 8s1
A jaka byłaby twoja konfiguracja jądra elektronicznego, ta kompaktowa? Jest:
[Og] 8s1
Zwróć uwagę na oczywiste uproszczenie lub skrót. W symbolu [Og] zliczonych jest wszystkie 118 elektronów zapisanych powyżej, więc ten niepewny pierwiastek ma 119 elektronów, z których tylko jeden ma wartościowość (znajdowałby się poniżej fransu w układzie okresowym).
Przykłady
generał
Załóżmy teraz, że chcesz stopniowo tworzyć skrót:
[On] 2sdwa 2 P6 3sdwa 3p6 4sdwa 3d10 4p6 5sdwa 4d10 5 pkt6 6sdwa 4f14 5 d10 6p6 7sdwa 5f14 6d10 7p6
Zwróć uwagę, że 1sdwa został zastąpiony przez [On]. Następnym gazem szlachetnym jest neon, który ma 10 elektronów. Wiedząc o tym, skrót kontynuuje:
[Ne] 3sdwa 3p6 4sdwa 3d10 4p6 5sdwa 4d10 5 pkt6 6sdwa 4f14 5 d10 6p6 7sdwa 5f14 6d10 7p6
Następnie następuje argon z 18 elektronami:
[Ar] 4sdwa 3d10 4p6 5sdwa 4d10 5 pkt6 6sdwa 4f14 5 d10 6p6 7sdwa 5f14 6d10 7p6
Ponieważ kolejnym gazem szlachetnym jest krypton, skrót jest przesuwany o kolejne 36 elektronów:
[Kr] 5sdwa 4d10 5 pkt6 6sdwa 4f14 5 d10 6p6 7sdwa 5f14 6d10 7p6
Xenon ma 54 elektrony, dlatego przenosimy skrót na orbital 5p:
[Xe] 6sdwa 4f14 5 d10 6p6 7sdwa 5f14 6d10 7p6
Do tej pory zauważyłeś, że konfiguracja elektronów jest zawsze skracana do orbitalu np; to znaczy, gazy szlachetne mają te orbitale wypełnione elektronami. I wreszcie radon z 86 elektronami, więc skracamy do orbitalu 6p:
[Rn] 7sdwa 5f14 6d10 7p6
Tlen
Tlen ma osiem elektronów, a jego pełna konfiguracja elektroniczna to:
1sdwa2sdwa2 P4
Jedynym skrótem, jakiego możemy użyć, jest [He] przez 1sdwa. W ten sposób Twoja elektroniczna konfiguracja jądra wygląda następująco:
[On] 2sdwa2 P4
Potas
Potas ma dziewiętnaście elektronów, a jego pełna konfiguracja elektroniczna to:
1sdwa 2sdwa 2 P6 3sdwa 3p6 4s1
Zauważ, że możemy użyć symbolu [He], aby skrócić tę konfigurację; jak również [Ne] i [Ar]. Ten ostatni jest używany, ponieważ argon jest gazem szlachetnym najbliższym potasowi. Więc twoja konfiguracja elektronów w jądrze wygląda następująco:
[Ar] 4s1
indyjski
Ind ma czterdzieści dziewięć elektronów, a jego pełna konfiguracja elektroniczna to:
1sdwa 2sdwa 2 P6 3sdwa 3p6 4sdwa 3d10 4p6 5sdwa 4d10 5 pkt1
Ponieważ krypton jest najbliższym gazem szlachetnym poprzedzającym ind, symbol [Kr] jest używany jako skrót i mamy jego konfigurację elektronową jądra:
[Kr] 5sdwa 4d10 5 pkt1
Chociaż orbitale 4d formalnie nie należą do jądra indu, ich elektrony nie są zaangażowane (przynajmniej w normalnych warunkach) w wiązanie metaliczne, ale raczej te z orbitali 5s i 5p..
Wolfram
Wolfram (lub wolfram) ma 74 elektrony, a jego pełna konfiguracja elektronowa to:
1sdwa 2sdwa 2 P6 3sdwa 3p6 4sdwa 3d10 4p6 5sdwa 4d10 5 pkt6 6sdwa 4f14 5 d4
Ponownie szukamy najbliższego gazu szlachetnego, który go poprzedza. W twoim przypadku odpowiada ksenonowi, który ma pełne orbitale 5p. Więc zamieniamy ciąg notacji kwantowych na symbol [Xe] i ostatecznie otrzymamy jego konfigurację elektronową jądra:
[Xe] 6sdwa 4f14 5 d4
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Pat Thayer. (2016). Diagramy konfiguracji elektronów. Źródło: chemistryapp.org
- Helmenstine, dr Anne Marie (5 grudnia 2018). Definicja rdzenia gazu szlachetnego. Odzyskane z: thinkco.com/
- Wikipedia. (2019). Elektroniczna Konfiguracja. Odzyskane z: es.wikipedia.org



Jeszcze bez komentarzy