
Charakterystyka DAPI (4 ', 6-diamidino-2-fenyloindol), uzasadnienie, zastosowanie
Plik DAPI (4 ', 6-diamidino-2-fenyloindol) Jest to barwnik, który ze względu na swoje właściwości fluorescencyjne pełni rolę markera, znajdując szerokie zastosowanie m.in. w mikroskopii fluorescencyjnej czy technice cytometrii przepływowej. Emitowana przez nią fluorescencja jest jasnoniebieska, jej wzbudzenie zachodzi między 455-461 nm (światło UV).
Barwnik DAPI może z dużą łatwością przechodzić przez błonę komórkową martwych komórek. Może również zabarwić jądra żywych komórek, ale w tym przypadku stężenie tego musi być wyższe.
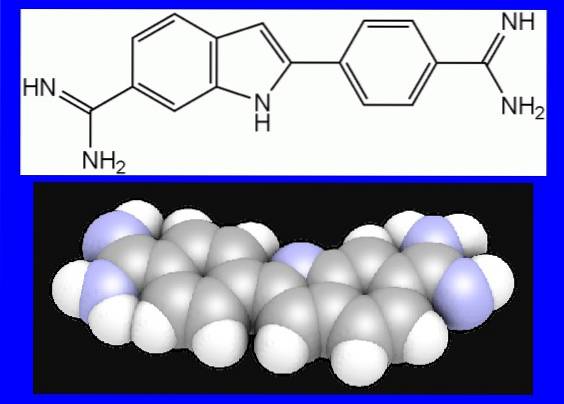
Barwnik jest zdolny do dostępu do DNA komórkowego, do którego ma szczególne powinowactwo, wiążąc się z wielką zachłannością z zasadami azotowymi adeniny i tyminy. Z tego powodu jest bardzo przydatny w niektórych technikach biologii molekularnej..
Związek ten należy do grupy barwników indolowych i wykazano, że ma większą wrażliwość na DNA niż bromek etydyny i jodek propidyny, zwłaszcza na żelach agarozowych..
Zastosowanie tego barwnika fluorescencyjnego jest bardzo szerokie, ponieważ jest użyteczny do: badania zmian w DNA w procesach apoptotycznych (śmierć komórki), a tym samym wykrywania komórek w tym procesie; do wykonywania zdjęć DNA (drukowanie zdjęć DNA); badanie skażenia bakteryjnego; lub wizualizacji segmentacji jądrowej.
Został również wykorzystany w badaniu prążków chromosomalnych, w wykrywaniu DNA z Mycoplasmas sp, w interakcji DNA-białko, w barwieniu i liczeniu komórek metodą immunofluorescencji, a nawet w barwieniu dojrzałych ziaren pyłku.
Indeks artykułów
- 1 Funkcje
- 2 Uzasadnienie
- 3 Użyj
- 3.1 Cytometria przepływowa
- 3.2 Mikrofluorometria przepływowa
- 3.3 Hybrydyzacja in situ
- 3.4 Barwienie immunofluorescencyjne
- 4 Karta bezpieczeństwa
- 5 Referencje
Charakterystyka
DAPI jest skrótem od nazwy chemicznej (4 ', 6-diamidino-2-fenyloindol). Jego wzór cząsteczkowy to C.16H.piętnaścieN5. Ma masę cząsteczkową 350,3. W pobliżu zakresu światła UV (345 do 358 nm) zachodzi maksymalne wzbudzenie kompleksu DAPI-DNA, podczas gdy maksymalna emisja fluorescencji występuje między 455-461 nm..
Barwnik ten charakteryzuje się tym, że jest żółtym proszkiem, ale struktury oznaczone tym fluoroforem emitują jasnoniebieskie światło..
Jest to związek rozpuszczalny w wodzie, jednak w celu przyspieszenia jego rozpuszczenia można zastosować trochę ciepła. Można go rozcieńczyć PBS, ale nie rozpuszcza się w nim bezpośrednio..
Po przygotowaniu barwnik należy go przechowywać w ciemności, czyli chronić przed światłem, w temperaturze od 2 do 8 ° C (lodówka). W tych warunkach barwnik jest stabilny dłużej niż 3 tygodnie lub miesiące..
Jeśli jest chroniony przed światłem, ale pozostawiony w temperaturze pokojowej, jego stabilność spada do 2 lub 3 tygodni, ale wystawiony na bezpośrednie działanie światła psuje się bardzo szybko. Jeśli chcesz przechowywać go znacznie dłużej, można go przechowywać w lodówce w temperaturze -20 ° C, rozprowadzając w porcjach.
Podstawa
Barwienie to opiera się na generowaniu jądrowego barwienia kontrastowego w głównych technikach biologii molekularnej, takich jak między innymi: cytometria przepływowa, mikroskopia fluorescencyjna oraz barwienie chromosomów metafazowych lub jąder międzyfazowych..
Technika ta opiera się na dużym powinowactwie barwnika do zasad azotowych (adeniny i tyminy) zawartych w materiale genetycznym (DNA) w mniejszym rowku. Na poziomie cytoplazmatycznym pozostawia bardzo małe tło.
Gdy barwnik fluorescencyjny wiąże się z regionami DNA adeniny i tyminy, fluorescencja znacznie wzrasta (20 razy więcej). Emitowany kolor jest jasnoniebieski. Warto zauważyć, że nie ma emisji fluorescencji podczas wiązania się z parami zasad GC (guanina-cytozyna).
Należy zauważyć, że chociaż ma również powinowactwo do RNA, nie powoduje to problemu, ponieważ najwyższy stopień emisji energii z tej cząsteczki występuje przy innej długości fali (500 nm), w przeciwieństwie do DNA, który robi to przy 460 nm . Ponadto wzrost fluorescencji po przyłączeniu do RNA wynosi tylko 20%..
DAPI jest używany bardziej do barwienia martwych (utrwalonych) komórek niż komórek żywych, ponieważ do barwienia tego ostatniego potrzebne jest znacznie wyższe stężenie barwnika, ponieważ błona komórkowa jest znacznie mniej przepuszczalna dla DAPI, gdy żyje.
Barwę DAPI można stosować w połączeniu z czerwonymi i zielonymi fluoroforami, aby uzyskać wielokolorowe wrażenia.
Posługiwać się
DAPI (4 ', 6-diamidyno-2-fenyloindol) jest doskonałym fluoroforem i dlatego jest szeroko stosowany w różnych technikach i do różnych celów. Zastosowanie DAPI w głównych technikach zostało wyjaśnione poniżej.
Cytometrii przepływowej
Badacze Gohde, Schumann i Zante w 1978 roku jako pierwsi zastosowali i zaproponowali DAPI jako fluorofor w technice cytometrii przepływowej, odnosząc wielki sukces ze względu na jego wysoką czułość na DNA i wysoką intensywność emisji fluorescencji..
Zastosowanie DAPI w tej technice pozwala na badanie cyklu komórkowego, kwantyfikację komórek oraz barwienie żywych i martwych komórek..
Chociaż istnieją inne barwniki, takie jak bromek etydyny, tlenek Hoechsta, oranż akrydyny i jodek propidyny, DAPI jest jednym z najczęściej używanych, ponieważ jest bardziej fotostabilny niż te wymienione wcześniej..
W przypadku tej techniki wymagane jest utrwalenie komórek, w tym celu można użyć absolutnego etanolu lub 4% paraformaldehydu. Próbkę odwirowuje się, a supernatant odrzuca, a następnie komórki nawadnia się przez dodanie 5 ml buforu PBS na 15 minut..
W miarę upływu czasu przygotuj barwnik DAPI za pomocą buforu do barwienia (FOXP3 firmy BioLegend) o stężeniu 3 µM.
Odwirować próbkę, odrzucić supernatant, a następnie przykryć 1 ml roztworu DAPI przez 15 minut w temperaturze pokojowej..
Przenieś próbkę do cytometru przepływowego za pomocą odpowiedniego lasera.
Mikrofluorometria przepływowa
Inną techniką, w której stosuje się DAPI, jest mikro-fluorometria przepływowa wraz z innym fluoroforem zwanym mithramycyną. Oba są przydatne do ilościowego oznaczania DNA chloroplastów indywidualnie, ale DAPI najlepiej nadaje się do pomiaru cząstek bakteriofaga T4..
Hybrydyzacja in situ
Ta technika zasadniczo wykorzystuje sondy DNA znakowane barwnikiem fluorescencyjnym, którym może być DAPI..
Próbka wymaga obróbki cieplnej w celu zdenaturowania dwuniciowego DNA i przekształcenia go w dwie jednoniciowe nici. Następnie hybrydyzuje się ze zdenaturowaną sondą DNA znakowaną DAPI, która ma interesującą sekwencję..
Później jest myte, aby wyeliminować to, co nie hybrydyzowało, a kontrast jest używany do wizualizacji DNA. Mikroskop fluorescencyjny umożliwia obserwację zhybrydyzowanej sondy.
Technika ta ma na celu wykrycie określonych sekwencji w chromosomalnym DNA, umożliwiając diagnozowanie niektórych chorób.
Te techniki cytomolekularne były bardzo pomocne w określaniu szczegółów badań kariotypów. Na przykład pokazał regiony bogate w pary zasad adenozyny i tyminy zwane regionami heterochromatycznymi lub pasmami DAPI..
Technika ta jest szeroko stosowana w badaniach chromosomów i chromatyny u roślin i zwierząt, a także w diagnostyce patologii prenatalnych i hematologicznych u ludzi..
W tej technice zalecane stężenie DAPI wynosi 150 ng / ml przez 15 minut..
Zmontowane szkiełka powinny być chronione przed światłem w temperaturze 2-8 ° C.
Barwienie immunofluorescencyjne
Komórki utrwalono 4% paraformaldehydem. Jeśli mają być użyte inne barwienia, na końcu pozostawia się DAPI jako barwnik kontrastowy, a komórki przykrywa się roztworem PBS na 15 minut. W miarę upływu czasu przygotuj roztwór DAPI, rozcieńczając go PBS, tak aby końcowe stężenie wynosiło 300 µM.
Następnie usuwa się nadmiar PBS i przykrywa DAPI na 5 minut. Jest kilkakrotnie prany. Szkiełko obserwuje się w mikroskopie fluorescencyjnym pod odpowiednim filtrem.
Karta bezpieczeństwa
Z tym związkiem należy obchodzić się ostrożnie, ponieważ jest to związek o właściwościach mutagennych. Węgiel aktywny służy do eliminacji tego związku z wodnych roztworów, które mają zostać odrzucone..
Aby uniknąć wypadków z tym odczynnikiem, należy używać rękawiczek, fartucha i okularów ochronnych. Jeśli dojdzie do kontaktu ze skórą lub błoną śluzową, miejsce to należy przemyć wystarczającą ilością wody.
Nigdy nie należy pipetować tego odczynnika ustami, należy używać pipet.
Nie zanieczyszczać odczynnika środkami drobnoustrojowymi, ponieważ prowadzi to do błędnych wyników.
Nie rozcieńczaj barwnika DAPI bardziej niż jest to zalecane, ponieważ znacznie obniży to jakość barwienia..
Nie wystawiaj odczynnika na bezpośrednie działanie światła ani nie trzymaj go w cieple, ponieważ zmniejsza to fluorescencję.
Bibliografia
- Brammer S, Toniazzo C i Poersch L. Corantes powszechnie zaangażowani w cytogenetykę roślin. Arch. Inst. Biol. 2015, 82. Dostępne w: scielo.
- Impath Laboratories. DAPI. Dostępne pod adresem: menarinidiagnostics.com/
- Laboratoria cytocell. 2019. Instrukcja korzystania z DAPI. dostępne na cytocell.com
- Elosegi A, Sabater S. Pojęcia i techniki w ekologii rzek. (2009). Redakcja Rubes, Hiszpania. Dostępne pod adresem: books.google.co.ve/
- Novaes R, Penitente A, Talvani A, Natali A, Neves C, Maldonado I.Użycie fluorescencji w zmodyfikowanej metodzie dysektora do oszacowania liczby miocytów w tkance serca. Arch. Bras. Cardiol. 2012; 98 (3): 252–258. Dostępne w: scielo.
- Rojas-Martínez R, Zavaleta-Mejía E, Rivas-Valencia P. Obecność fitoplazm w papai (Carica papaya) w Meksyku. Magazyn Chapingo. Seria ogrodnicza, 2011; 17 (1), 47-50. Dostępne pod adresem: scielo.org.


Jeszcze bez komentarzy