
Struktura, właściwości i zastosowania deuteru
Plik deuter jest jednym z izotopów wodoru, który jest reprezentowany jako D lub dwaH. Ponadto nazwano go ciężkim wodorem, ponieważ jego masa jest dwukrotnie większa od masy protonu. Izotop to gatunek, który pochodzi z tego samego pierwiastka chemicznego, ale którego liczba masowa różni się od podanej.
To rozróżnienie wynika z różnicy w liczbie posiadanych neutronów. Deuter jest uważany za stabilny izotop i można go znaleźć w naturalnie występujących związkach wodoru, chociaż w dość małej proporcji (mniej niż 0,02%).
Biorąc pod uwagę swoje właściwości, bardzo podobne do właściwości zwykłego wodoru, może zastąpić wodór we wszystkich reakcjach, w których uczestniczy, stając się substancjami równoważnymi..
Z tego i innych powodów izotop ten ma wiele zastosowań w różnych dziedzinach nauki, stając się jednym z najważniejszych.
Indeks artykułów
- 1 Struktura
- 1.1 Kilka faktów na temat deuteru
- 2 Właściwości
- 3 Zastosowania
- 4 Odnośniki
Struktura
Struktura deuteru składa się głównie z jądra, które ma proton i neutron, o masie lub masie atomowej około 2014 g.
Podobnie izotop ten zawdzięcza swoje odkrycie Haroldowi C.Ureyowi, chemikowi ze Stanów Zjednoczonych, i jego współpracownikom Ferdinandowi Brickwedde i George'owi Murphy'emu w 1931 roku..
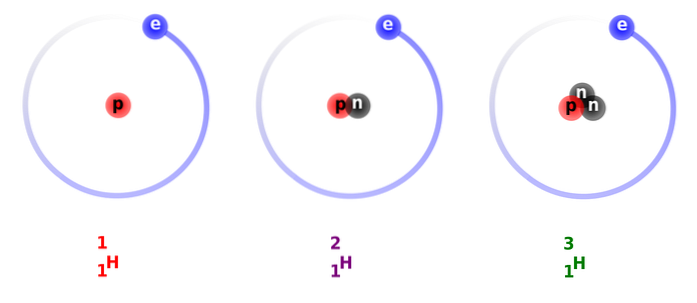
Na powyższym obrazku można zobaczyć porównanie struktur izotopów wodoru, które istnieją w postaci protu (jego najliczniejszego izotopu), deuteru i trytu, uporządkowane od lewej do prawej.
Przygotowanie deuteru w stanie czystym przeprowadzono pomyślnie po raz pierwszy w 1933 r., Ale od lat pięćdziesiątych XX wieku stosuje się substancję w fazie stałej, która wykazuje stabilność, zwaną deuterkiem litu (LiD), zastępując deuter i tryt w duża liczba reakcji chemicznych.
W tym sensie badano obfitość tego izotopu i zaobserwowano, że jego udział w wodzie może się nieznacznie różnić w zależności od źródła, z którego została pobrana próbka..
Ponadto badania spektroskopowe ustaliły istnienie tego izotopu na innych planetach w tej galaktyce..
Kilka faktów na temat deuteru
Jak stwierdzono powyżej, podstawowa różnica między izotopami wodoru (które jako jedyne zostały nazwane inaczej) polega na ich strukturze, ponieważ liczba protonów i neutronów w gatunku nadaje mu właściwości chemiczne.
Z drugiej strony deuter znajdujący się w ciałach gwiazdowych jest eliminowany z większą prędkością niż jest początkowy.
Ponadto uważa się, że inne zjawiska przyrody stanowią tylko jej niewielką część, więc jej produkcja nadal cieszy się zainteresowaniem..
Podobnie, seria badań wykazała, że zdecydowana większość atomów, które zostały uformowane z tego gatunku, pochodzi z Wielkiego Wybuchu; to jest powód, dla którego jego obecność jest zauważana na dużych planetach, takich jak Jowisz.
Ponieważ najpowszechniejszym sposobem pozyskiwania tego gatunku w przyrodzie jest występowanie go w połączeniu z wodorem w postaci protium, związek ustalony między proporcjami obu gatunków w różnych dziedzinach nauki nadal budzi zainteresowanie społeczności naukowej. takich jak astronomia czy klimatologia.
Nieruchomości
- Jest to izotop pozbawiony właściwości radioaktywnych; to znaczy ma dość stabilny charakter.
- Może być stosowany do zastępowania atomu wodoru w reakcjach chemicznych.
- Gatunek ten zachowuje się inaczej niż zwykły wodór w reakcjach o charakterze biochemicznym..
- Kiedy dwa atomy wodoru zostaną zastąpione w wodzie, otrzymamy D.dwaLub nabierając nazwy ciężkiej wody.
- Wodór obecny w oceanie w postaci deuteru występuje w proporcji 0,016% w stosunku do protu.
- W gwiazdach ten izotop ma tendencję do szybkiego łączenia się, tworząc hel..
- DdwaO jest gatunkiem toksycznym, chociaż jego właściwości chemiczne są bardzo podobne do właściwości H.dwa
- Kiedy atomy deuteru są poddawane procesowi syntezy jądrowej w wysokich temperaturach, uwalniane są duże ilości energii.
- Właściwości fizyczne, takie jak temperatura wrzenia, gęstość, ciepło parowania, punkt potrójny, między innymi, mają większe wielkości w cząsteczkach deuteru (Ddwa) niż w wodorze (H.dwa).
- Najpowszechniejsza forma, w której występuje, jest związana z atomem wodoru, powodując deuterek wodoru (HD).
Aplikacje
Ze względu na swoje właściwości deuter jest używany w wielu różnych zastosowaniach, w których bierze udział wodór. Niektóre z tych zastosowań opisano poniżej:
- W biochemii służy do znakowania izotopowego, polegającego na „znakowaniu” próbki wybranym izotopem w celu prześledzenia jej przejścia przez określony układ..
- W reaktorach jądrowych, w których przeprowadzane są reakcje syntezy jądrowej, jest stosowany do zmniejszania prędkości, z jaką poruszają się neutrony bez wysokiej absorpcji tych, które przedstawia zwykły wodór..
- W obszarze magnetycznego rezonansu jądrowego (NMR) rozpuszczalniki na bazie deuteru służą do otrzymywania próbek tego typu spektroskopii bez obecności zakłóceń, jakie występują przy stosowaniu rozpuszczalników uwodornionych..
- W dziedzinie biologii makrocząsteczki są badane za pomocą technik rozpraszania neutronów, w których próbki wyposażone w deuter są wykorzystywane do znacznego zmniejszenia szumu w tych właściwościach kontrastu..
- W obszarze farmakologii zastępowanie wodoru deuterem jest stosowane ze względu na generowany kinetyczny efekt izotopowy, który pozwala tym lekom na dłuższy okres półtrwania.
Bibliografia
- Britannica, E. (s.f.). Deuter. Odzyskany z britannica.com
- Wikipedia. (s.f.). Deuter. Pobrane z en.wikipedia.org
- Chang, R. (2007). Chemia, wydanie dziewiąte. Meksyk: McGraw-Hill.
- Hiperfizyka. (s.f.). Obfitość deuteru. Odzyskany z hyperphysics.phy-astr.gsu.edu
- ThoughtCo. (s.f.). Fakty dotyczące deuteru. Pobrane z thinkco.com



Jeszcze bez komentarzy