
Diagram Moellera z czego się składa i rozwiązanych ćwiczeń
Plik Schemat Moellera o Metoda Rain to graficzna i mnemoniczna metoda nauki reguły Madelunga; czyli jak napisać konfigurację elektronową elementu. Charakteryzuje się przeciąganiem przekątnych przez kolumny orbitali i podążając za kierunkiem strzałki, ustala się odpowiednią ich kolejność dla atomu.
W niektórych częściach świata diagram Moellera jest również znany jako metoda deszczowa. W ten sposób określa się porządek wypełniania orbitali, które są również określone przez trzy liczby kwantowe n, l Y ml.
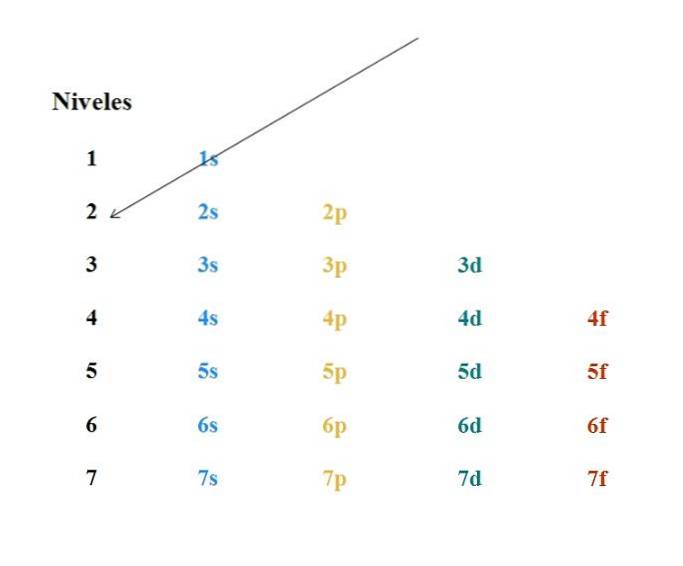
Na powyższym obrazku pokazano prosty schemat Moellera. Każda kolumna odpowiada różnym orbitalom: s, p, d i f, wraz z ich odpowiednimi poziomami energii. Pierwsza strzałka wskazuje, że wypełnienie dowolnego atomu musi rozpoczynać się od orbity 1s.
Zatem następna strzałka musi zaczynać się od orbity 2s, a następnie od orbitalu 2p do orbitalu 3s. W ten sposób, jakby to był deszcz, orbitale i liczba zawartych w nich elektronów (4l+dwa).
Diagram Moellera stanowi wprowadzenie dla tych, którzy badają konfiguracje elektronów..
Indeks artykułów
- 1 Czym jest diagram Moellera?
- 1.1 Reguła Madelunga
- 1.2 Kroki do naśladowania
- 2 ćwiczenia rozwiązane
- 2.1 Beryl
- 2.2 Fosfor
- 2.3 Cyrkon
- 2.4 Iridium
- 2.5 Wyjątki od diagramu Moellera i reguły Madelunga
- 3 Odnośniki
Jaki jest diagram Moellera?
Reguła Madelunga
Ponieważ diagram Moellera składa się z graficznej reprezentacji reguły Madelunga, należy wiedzieć, jak działa ta ostatnia. Wypełnianie orbitali musi podlegać następującym dwóm zasadom:
-Orbitale o najniższych wartościach n+l są wypełnione jako pierwsze, będąc n główna liczba kwantowa, i l moment pędu orbity. Na przykład orbital 3d odpowiada n= 3 i l= 2, więc, n+l= 3 + 2 = 5; tymczasem orbital 4s odpowiada n= 4 i l= 0 i n+l= 4 + 0 = 4. Z powyższego wynika, że elektrony najpierw wypełniają orbital 4s niż 3d.
-Jeśli dwa orbitale mają tę samą wartość n+l, elektrony zajmą najpierw ten o najniższej wartości n. Na przykład orbital 3d ma wartość n+l= 5, jak orbital 4p (4 + 1 = 5); ale ponieważ 3d ma najmniejszą wartość n, zapełni się wcześniej niż 4 pensy.
Z dwóch poprzednich obserwacji można uzyskać następującą kolejność wypełniania orbitali: 1s 2s 2p 3s 3p 4s 3d 4p.
Wykonaj te same kroki dla różnych wartości n+l dla każdej orbity uzyskuje się konfiguracje elektroniczne innych atomów; co z kolei można również określić graficznie za pomocą wykresu Moellera.
Kroki do naśladowania
Reguła Madelunga określa wzór n+l, za pomocą których można „uzbroić” konfigurację elektroniczną. Jednak, jak wspomniano, diagram Moellera już to przedstawia graficznie; więc po prostu podążaj za jego kolumnami i krok po kroku rysuj przekątne.
Jak więc rozpocząć elektroniczną konfigurację atomu? Aby to zrobić, musisz najpierw poznać jego liczbę atomową Z, która z definicji dla neutralnego atomu jest równa liczbie elektronów.
W ten sposób przy Z uzyskuje się liczbę elektronów i mając to na uwadze, zaczynamy rysować przekątne przez diagram Moellera.
Orbitale s mogą pomieścić dwa elektrony (stosując wzór 4l+2), p sześć elektronów, d dziesięć i piętnaście czternastu. Zatrzymuje się na orbicie, na którym zajęty został ostatni elektron podany przez Z.
Dla dalszego wyjaśnienia poniżej znajduje się seria rozwiązanych ćwiczeń.
Rozwiązane ćwiczenia
Beryl
Używając układu okresowego, pierwiastek beryl znajduje się przy Z = 4; to znaczy, że jego cztery elektrony muszą być umieszczone na orbitali.
Zaczynając od pierwszej strzałki na diagramie Moellera, orbital 1s zajmuje dwa elektrony: 1sdwa; a następnie orbital 2s, z dwoma dodatkowymi elektronami, które dają łącznie 4: 2sdwa.
Dlatego konfiguracja elektronowa berylu, wyrażona jako [Be], wynosi 1sdwa2sdwa. Zauważ, że suma indeksów górnych jest równa liczbie wszystkich elektronów.
Mecz
Pierwiastek fosforowy ma Z = 15, a zatem ma łącznie 15 elektronów, które muszą zajmować orbitale. Aby przejść dalej, zaczynasz od razu z ustawieniem 1sdwa2sdwa, który zawiera 4 elektrony. Wtedy brakowałoby jeszcze 9 elektronów.
Po orbitalu 2s, następna strzała "wchodzi" przez orbital 2p, ostatecznie lądując na orbitalu 3s. Ponieważ orbitale 2p mogą zajmować 6 elektronów, a 3s 2 elektrony, mamy: 1sdwa2sdwa2 P63sdwa.
Wciąż brakuje jeszcze 3 elektronów, które zajmują następujący orbital 3p zgodnie ze schematem Moellera: 1sdwa2sdwa2 P63sdwa3p3, konfiguracja elektronowa luminoforu [P].
Cyrkon
Pierwiastek cyrkonu ma Z = 40. Skracanie ścieżki przy konfiguracji 1sdwa2sdwa2 P63sdwa3p6, przy 18 elektronach (w argonie z gazu szlachetnego), brakowałoby kolejnych 22 elektronów. Po orbitalu 3p, następne wypełnienie zgodnie ze schematem Moellera to orbitale 4s, 3d, 4p i 5s.
Wypełnianie ich całkowicie, czyli 4sdwa, 3d10, 4p6 i 5sdwa, w sumie dodaje się 20 elektronów. Pozostałe 2 elektrony są zatem umieszczone na następującym orbicie: 4d. Zatem konfiguracja elektronowa cyrkonu, [Zr] wynosi: 1sdwa2sdwa2 P63sdwa3p64sdwa3d104p65sdwa4ddwa.
Iridium
Iryd ma Z = 77, więc ma 37 dodatkowych elektronów w porównaniu z cyrkonem. Począwszy od [Cd], czyli 1sdwa2sdwa2 P63sdwa3p64sdwa3d104p65sdwa4d10, dodaj 29 elektronów z następującymi orbitaliami diagramu Moellera.
Rysując nowe przekątne, nowe orbitale to: 5p, 6s, 4f i 5d. Wypełniając całkowicie pierwsze trzy orbitale, mamy: 5p6, 6sdwa i 4f14, w sumie 22 elektrony.
Brakuje więc 7 elektronów, które są na orbicie 5d: 1s.dwa2sdwa2 P63sdwa3p64sdwa3d104p65sdwa4d105 pkt66sdwa4f145 d7.
Powyższe jest konfiguracją elektronową irydu, [Go]. Zauważ, że orbitale 6sdwa i 5d7 są wyróżnione pogrubioną czcionką, aby wskazać, że odpowiednio odpowiadają warstwie walencyjnej tego metalu.
Wyjątki od diagramu Moellera i reguły Madelunga
W układzie okresowym jest wiele elementów, które nie są zgodne z tym, co zostało właśnie wyjaśnione. Ich konfiguracje elektronów różnią się eksperymentalnie od przewidywanych z powodów kwantowych..
Wśród pierwiastków wykazujących te rozbieżności są: chrom (Z = 24), miedź (Z = 29), srebro (Z = 47), rod (Z = 45), cer (Z = 58), niob (Z = 41) i wiele więcej.
Wyjątki są bardzo częste w wypełnianiu orbitali di f. Na przykład chrom powinien mieć ustawienie wartościowości 4sdwa3d4 zgodnie ze schematem Moellera i regułą Madelunga, ale tak naprawdę to 4s13d5.
I wreszcie, ustawienie wartościowości srebra powinno wynosić 5sdwa4d9; ale tak naprawdę to 5s14d10.
Bibliografia
- Gavira J. Vallejo M. (6 sierpnia 2013). Wyjątki od reguły Madelunga i diagramu Moellera w elektronicznej konfiguracji pierwiastków chemicznych. Odzyskany z: triplenlace.com
- Moja superklasa. (s.f.) Co to jest konfiguracja elektronów? Odzyskany z: misuperclase.com
- Wikipedia. (2018). Schemat Moellera. Odzyskane z: es.wikipedia.org
- Manekiny. (2018). Jak przedstawić elektrony na diagramie poziomu energii. Odzyskany z: dummies.com
- Nave R. (2016). Kolejność wypełniania stanów elektronowych. Odzyskane z: hyperphysics.phy-astr.gsu.edu



Jeszcze bez komentarzy