
Charakterystyka, struktura i funkcje domeny SH2
Plik Domena SH2 (Src Homology 2) jest wysoce konserwatywną domeną białkową w ewolucji i występuje w ponad 100 różnych białkach, z których najważniejszym jest onkoproteina src, zaangażowana w proces transdukcji sygnału w komórce.
Funkcją domeny jest wiązanie się z fosforylowanymi sekwencjami tyrozyny na białkach docelowych; Ten związek wyzwala serię sygnałów, które regulują ekspresję genów. Domena ta została również znaleziona w enzymie fosfatazy tyrozynowej.
Domeny SH2 na ogół znajdują się razem z innymi domenami, które zostały powiązane ze szlakami transdukcji sygnału. Jedną z najczęstszych interakcji jest połączenie z domeną SH2 i SH3, która wydaje się być zaangażowana w regulację interakcji z sekwencjami bogatymi w prolinę..
Białka mogą zawierać pojedynczą domenę SH2 lub więcej niż jedną, na przykład białko GAP i podjednostkę p85 3-kinaz fosfoinozytolowych..
Domena SH2 była szeroko badana przez przemysł farmaceutyczny w celu wytwarzania leków zwalczających między innymi choroby, takie jak rak, alergie, choroby autoimmunologiczne, astma, AIDS, osteoporoza..
Indeks artykułów
- 1 Funkcje
- 2 Struktura
- 3 Funkcje
- 4 Ewolucja
- 5 Implikacje kliniczne
- 5.1 Limfoproliferacyjny sprzężony z chromosomem X
- 5.2 Agammaglobulinemia sprzężona z chromosomem X
- 5.3 Zespół Noonan
- 6 Odnośniki
Charakterystyka
Domena SH2 składa się z około 100 aminokwasów połączonych z domenami katalitycznymi. Najbardziej oczywistym przykładem są enzymy kinazy tyrozynowej, które są odpowiedzialne za katalizowanie przeniesienia grupy fosforanowej z ATP do reszt aminokwasowych tyrozyny..
Ponadto, domeny SH2 opisano w domenach niekatalitycznych, takich jak crk, grb2 / sem5 i nck..
Domeny SH2 są obecne u wyższych eukariontów i sugeruje się, że pojawiają się również u drożdży. W odniesieniu do bakterii w Escherichia coli zgłoszono moduł przypominający domeny SH2.
Białko src jest pierwszą odkrytą kinazą tyrozynową, która po zmutowaniu prawdopodobnie bierze udział w regulacji aktywności kinazy, a także w promowaniu interakcji tych białek z innymi składnikami w komórce.
Po odkryciu domen w białku scr, domenę SH2 zidentyfikowano w znacznej liczbie bardzo zróżnicowanych białek, w tym białkowych kinaz tyrozynowych i czynnikach transkrypcyjnych..
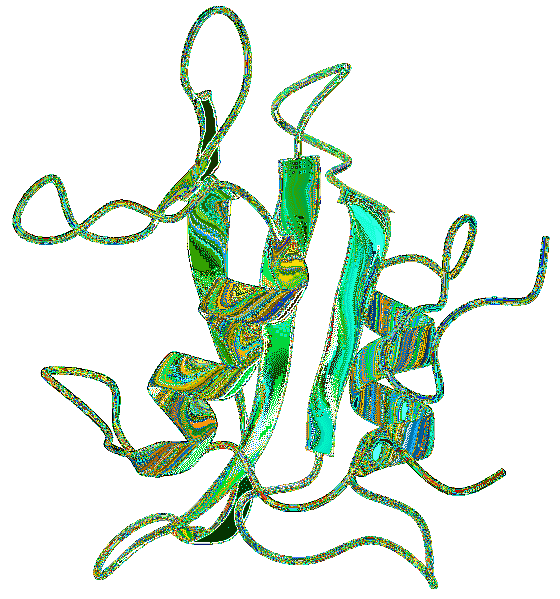
Struktura
Strukturę domeny SH2 odkryto za pomocą technik, takich jak dyfrakcja rentgenowska, krystalografia i NMR (jądrowy rezonans magnetyczny), znajdując wspólne wzorce w strukturze drugorzędowej badanych domen SH2..
Domena SH2 ma pięć wysoce konserwatywnych motywów. Domena ogólna składa się z rdzenia β arkuszy z małymi sąsiednimi częściami antyrównoległych arkuszy β, flankowanych przez dwie helisy α..
Reszty aminokwasów po jednej stronie liścia iw regionie N-końcowym αA biorą udział w koordynowaniu wiązania peptydów. Jednak pozostałe cechy białek są dość zróżnicowane między badanymi domenami..
W końcowej części węgla reszta izoleucyny znajduje się na trzeciej pozycji i tworzy hydrofobową kieszeń na powierzchni domeny SH2..
Ważną cechą jest istnienie dwóch regionów, z których każdy ma określoną funkcję. Obszar między pierwszą helisą α a arkuszem β jest miejscem rozpoznawania fosfotyrozyny.
Podobnie region między arkuszem β i α helisą końcowego węgla tworzy region odpowiedzialny za interakcję z końcowymi resztami węgla fosfotyrozyny.
funkcje
Funkcją domeny SH2 jest rozpoznawanie stanu fosforylacji reszt aminokwasowych tyrozyny. Zjawisko to ma kluczowe znaczenie w transdukcji sygnału, gdy cząsteczka znajdująca się na zewnątrz komórki jest rozpoznawana przez receptor na błonie i przetwarzana wewnątrz komórki..
Transdukcja sygnału jest niezwykle ważnym zdarzeniem regulacyjnym, w którym komórka reaguje na zmiany w swoim środowisku zewnątrzkomórkowym. Proces ten zachodzi dzięki transdukcji zewnętrznych sygnałów zawartych w niektórych przekaźnikach molekularnych przez ich błonę..
Fosforylacja tyrozyny prowadzi do sekwencyjnej aktywacji interakcji białko-białko, co skutkuje zmianą ekspresji genów lub zmienioną odpowiedzią komórkową.
Białka zawierające domeny SH2 biorą udział w szlakach regulatorowych związanych z podstawowymi procesami komórkowymi, takimi jak rearanżacja cytoszkieletu, homeostaza, odpowiedzi immunologiczne i rozwój..
Ewolucja
Obecność domeny SH2 została odnotowana w prymitywnym organizmie jednokomórkowym Monosiga brevicollis. Uważa się, że domena ta wyewoluowała jako niezmienna jednostka sygnalizacyjna wraz z pojawieniem się fosforylacji tyrozyny..
Spekuluje się, że rodowe uporządkowanie domeny służyło do kierowania kinaz na ich substraty. Tak więc, wraz ze wzrostem złożoności organizmów, domeny SH2 uzyskały w toku ewolucji nowe funkcje, takie jak allosteryczna regulacja domeny katalitycznej kinaz..
Implikacje kliniczne
Limfoproliferacyjny sprzężony z chromosomem X.
Niektóre zmutowane domeny SH2 zostały zidentyfikowane jako powodujące chorobę. Mutacje w domenie SH2 w SAP powodują chorobę limfoproliferacyjną sprzężoną z chromosomem X, co powoduje wysoki wzrost wrażliwości na niektóre wirusy, a tym samym niekontrolowaną proliferację limfocytów B..
Proliferacja występuje, ponieważ mutacja domen SH2 powoduje awarie w szlakach sygnałowych między komórkami B i T, prowadząc do infekcji wirusowych i niekontrolowanego wzrostu komórek B. Choroba ta charakteryzuje się wysoką śmiertelnością.
Agammaglobulinemia sprzężona z chromosomem X
Podobnie mutacje strut w domenie SH2 kinazy białkowej Brutona są odpowiedzialne za stan zwany agammaglobulinemią..
Ten stan jest sprzężony z chromosomem X, charakteryzuje się brakiem komórek B i wyraźnym spadkiem poziomów immunoglobulin..
Zespół Noonan
Wreszcie mutacje w N-końcowym regionie domeny SH2 białkowej fosfatazy tyrozynowej 2 są przyczyną zespołu Noonan..
Ta patologia charakteryzuje się głównie chorobami serca, niskim wzrostem spowodowanym wolniejszym wzrostem oraz nieprawidłowościami dotyczącymi twarzy i szkieletu. Ponadto stan ten może objawiać się upośledzeniem umysłowym i psychomotorycznym w jednej czwartej badanych przypadków..
Bibliografia
- Berg, J. M., Stryer, L. i Tymoczko, J. L. (2007). Biochemia. Wywrócony.
- Filippakopoulos, P., Müller, S. i Knapp, S. (2009). Domeny SH2: modulatory aktywności niereceptorowej kinazy tyrozynowej. Aktualna opinia w biologii strukturalnej, 19(6), 643-649.
- Kurochkina, N. (red.). (2015). Domeny Sh: struktura, mechanizmy i aplikacje. Skoczek.
- Sawyer, T. K. (1998). Homologia Src - 2 domeny: Struktura, mechanizmy i odkrywanie leków. Nauka o peptydach, 47(3), 243-261.
- Schlessinger, J. (1994). Białka sygnalizacyjne SH2 / SH3. Aktualna opinia w dziedzinie genetyki i rozwoju, 4(1), 25-30.

Jeszcze bez komentarzy