
Charakterystyka i przykłady polarnych wiązań kowalencyjnych

ZA polarne wiązanie kowalencyjne Jest to ten utworzony między dwoma pierwiastkami chemicznymi, których różnica elektroujemności jest znaczna, ale nie zbliża się do charakteru czysto jonowego. Jest to zatem silne oddziaływanie pośrednie między apolarnymi wiązaniami kowalencyjnymi a wiązaniami jonowymi..
Mówi się, że jest kowalencyjny, ponieważ teoretycznie istnieje równy udział pary elektronów między dwoma związanymi atomami; to znaczy, że dwa elektrony są dzielone równo. Atom E przekazuje elektron, podczas gdy X wnosi wkład do drugiego elektronu, tworząc wiązanie kowalencyjne E: X lub E-X.
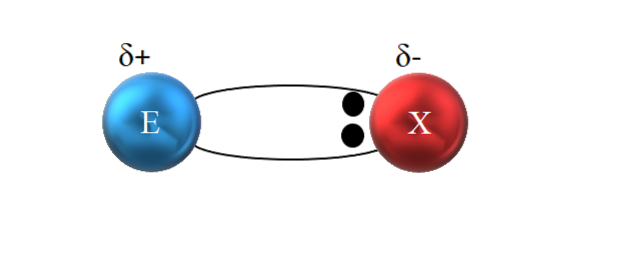
Jednak, jak widać na powyższym obrazku, te dwa elektrony nie znajdują się w centrum E i X, co wskazuje, że „krążą” z tą samą częstotliwością między obydwoma atomami; raczej są bliżej X niż E. Oznacza to, że X przyciągnął parę elektronów do siebie ze względu na wyższą elektroujemność.
Ponieważ elektrony wiązania są bliżej X niż E, wokół X tworzy się region o dużej gęstości elektronów, δ-; podczas gdy w E pojawia się region ubogi w elektrony, δ +. Dlatego występuje polaryzacja ładunków elektrycznych: biegunowe wiązanie kowalencyjne.
Indeks artykułów
- 1 Funkcje
- 1.1 Stopnie biegunowości
- 1.2 Pierwiastki chemiczne, które je tworzą
- 1.3 Charakter polarny i jonowy
- 2 Przykłady polarnego wiązania kowalencyjnego
- 2.1 C-O
- 2,2 H-X
- 2.3 O-H
- 2,4 N-H
- 2,5 Fe-O
- 3 Odnośniki
Charakterystyka
Stopnie biegunowości
Wiązania kowalencyjne są z natury bardzo liczne. Występują praktycznie we wszystkich heterogenicznych cząsteczkach i związkach chemicznych; ponieważ ostatecznie powstaje, gdy dwa różne atomy E i X łączą się. Istnieją jednak wiązania kowalencyjne bardziej polarne niż inne i aby się tego dowiedzieć, należy uciec się do elektroujemności.
Im bardziej elektroujemny X i mniej elektroujemny E (elektrododatni), to powstałe wiązanie kowalencyjne będzie bardziej polarne. Tradycyjnym sposobem oszacowania tej polaryzacji jest wzór:
χX - χI
Gdzie χ jest elektroujemnością każdego atomu zgodnie ze skalą Paulinga.
Jeśli to odejmowanie lub odejmowanie ma wartości między 0,5 a 2, to będzie to wiązanie biegunowe. Dlatego możliwe jest porównanie stopnia polaryzacji między różnymi łączami E-X. W przypadku, gdy uzyskana wartość jest wyższa niż 2, mówimy o wiązaniu jonowym E+X- Tak nie jestδ+-Xδ-.
Jednak biegunowość wiązania E-X nie jest absolutna, ale zależy od otoczenia molekularnego; to znaczy w cząsteczce -E-X-, gdzie E i X tworzą wiązania kowalencyjne z innymi atomami, te ostatnie bezpośrednio wpływają na wspomniany stopień polarności.
Pierwiastki chemiczne, które je tworzą
Chociaż E i X mogą być dowolnym pierwiastkiem, nie wszystkie z nich powodują polarne wiązania kowalencyjne. Na przykład, jeśli E jest metalem silnie elektrododatnim, takim jak metal alkaliczny (Li, Na, K, Rb i Cs), a X jest halogenem (F, Cl, Br i I), będą one miały tendencję do tworzenia związków jonowych (Na+Cl-) i żadnych cząsteczek (Na-Cl).
Właśnie dlatego polarne wiązania kowalencyjne zwykle występują między dwoma niemetalicznymi pierwiastkami; iw mniejszym stopniu między pierwiastkami niemetalicznymi a niektórymi metalami przejściowymi. Oglądanie bloku p układu okresowego, masz wiele opcji tworzenia tego typu wiązań chemicznych.
Charakter polarny i jonowy
W dużych cząsteczkach nie jest bardzo ważne, aby zastanowić się, jak polarne jest wiązanie; Są one silnie kowalencyjne, a rozkład ich ładunków elektrycznych (w obszarach bogatych lub ubogich w elektrony) zwraca większą uwagę niż określenie stopnia kowalencyjności ich wewnętrznych wiązań..
Jednak w przypadku dwuatomowych lub małych cząsteczek wspomniana biegunowość Eδ+-Xδ- to dość względne.
Nie stanowi to problemu w przypadku cząsteczek utworzonych między niemetalicznymi pierwiastkami; Ale kiedy uczestniczą metale przejściowe lub metaloidy, nie mówimy już tylko o polarnym wiązaniu kowalencyjnym, ale o wiązaniu kowalencyjnym o pewnym charakterze jonowym; a w przypadku metali przejściowych, kowalencyjne wiązanie koordynacyjne ze względu na jego naturę.
Przykłady polarnego wiązania kowalencyjnego
WSPÓŁ
Wiązanie kowalencyjne między węglem a tlenem jest polarne, ponieważ ten pierwszy jest mniej elektroujemny (χdo = 2,55) niż druga (χLUB = 3,44). Dlatego, gdy widzimy wiązania C-O, C = O lub C-O-, będziemy wiedzieć, że są to wiązania polarne.
H-X
Halogenki wodoru, HX, są idealnymi przykładami do zrozumienia wiązań polarnych w cząsteczkach dwuatomowych. Mając elektroujemność wodoru (χH. = 2,2), możemy oszacować, jak polarne są względem siebie te halogenki:
-HF (H-F), χfa (3,98) - χH. (2,2) = 1,78
-HCl (H-Cl), χCl (3,16) - χH. (2,2) = 0,96
-HBr (H-Br), χBr (2,96) - χH. (2,2) = 0,76
-HI (H-I), χja (2,66) - χH. (2,2) = 0,46
Zauważ, że zgodnie z tymi obliczeniami wiązanie H-F jest najbardziej polarne ze wszystkich. Otóż, jaki jest jego charakter jonowy wyrażony w procentach, to już inna sprawa. Wynik ten nie jest zaskakujący, ponieważ fluor jest pierwiastkiem najbardziej elektroujemnym ze wszystkich..
Gdy elektroujemność spada z chloru na jod, wiązania H-Cl, H-Br i H-I również stają się mniej polarne. Wiązanie H-I powinno być niepolarne, ale w rzeczywistości jest polarne i również bardzo „kruche”; łatwo pęka.
O
Wiązanie polarne O-H jest chyba najważniejsze ze wszystkich: dzięki niemu istnieje życie, ponieważ współpracuje z momentem dipolowym wody. Jeśli oszacujemy różnicę między elektroujemnościami tlenu i wodorów, otrzymamy:
χLUB (3,44) - χH. (2,2) = 1,24
Jednak cząsteczka wody, H.dwaAlbo masz dwa z tych wiązań, H-O-H. To oraz geometria kątowa cząsteczki i jej asymetria sprawiają, że jest to wysoce polarny związek..
N-H
Wiązanie N-H występuje w grupach aminowych białek. Powtarzając te same obliczenia, które mamy:
χN (3,04) - χH. (2,2) = 0,84
Odzwierciedla to, że wiązanie N-H jest mniej polarne niż O-H (1,24) i F-H (1,78).
Brzydki
Wiązanie Fe-O jest ważne, ponieważ jego tlenki znajdują się w minerałach żelaza. Zobaczmy, czy jest bardziej polarny niż H-O:
χLUB (3,44) - χWiara (1,83) = 1,61
Stąd słusznie przyjmuje się, że wiązanie Fe-O jest bardziej polarne niż wiązanie H-O (1.24); lub co jest tym samym, co powiedzenie: Fe-O ma większy charakter jonowy niż H-O.
Obliczenia te służą do określenia stopni polaryzacji między różnymi łączami; ale nie są one wystarczające do określenia, czy związek jest jonowy, kowalencyjny, czy też ma charakter jonowy.
Bibliografia
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Laura Nappi. (2019). Wiązania kowalencyjne biegunowe i niepolarne: definicje i przykłady. Nauka. Odzyskany z: study.com
- Helmenstine, dr Anne Marie (18 września 2019). Definicja i przykłady wiązania biegunowego (biegunowe wiązanie kowalencyjne). Odzyskany z: thinkco.com
- Elsevier B.V. (2019). Wiązanie kowalencyjne biegunowe. ScienceDirect. Odzyskany z: sciencedirect.com
- Wikipedia. (2019). Polaryzacja chemiczna. Odzyskane z: en.wikipedia.org
- Anonimowy. (05 czerwca 2019). Właściwości polarnych wiązań kowalencyjnych. Chemia LibreTexts. Źródło: chem.libretexts.org



Jeszcze bez komentarzy