
Entalpia definicji reakcji, termochemia, ćwiczenia
Plik entalpia reakcji jest funkcją termodynamiczną, która umożliwia obliczenie ciepła uzyskanego lub dostarczonego w reakcji chemicznej, pod warunkiem, że reakcja ta zachodziła pod stałym ciśnieniem. Jest definiowana jako energia wewnętrzna U plus iloczyn ciśnienia P przez objętość V substancji biorących udział w reakcji chemicznej, jak następuje: H = U + P ∙ V
Dlatego entalpia ma wymiary energii, aw Międzynarodowym Systemie Pomiarów jest mierzona w dżulach. Aby zrozumieć związek entalpii z ciepłem wymienianym w reakcji chemicznej, należy pamiętać o pierwszej zasadzie termodynamiki, która brzmi następująco: Q = ΔU + W

Pierwsza zasada stanowi, że ciepło wymieniane w procesie termodynamicznym jest równe zmianie energii wewnętrznej substancji biorących udział w procesie oraz pracy wykonanej przez te substancje w procesie..
W każdym procesie praca W jest obliczana za pomocą następującej zależności:
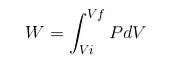
W powyższym wyrażeniu Vi to objętość początkowa, Vf objętość końcowa, a P to ciśnienie. Jeśli proces jest przeprowadzany przy stałym ciśnieniu P, wówczas wynikowa praca będzie:
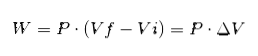
Gdzie ΔV to zmiana objętości.
Indeks artykułów
- 1 Definicja
- 2 Związek z ciepłem
- 3 Standardowa entalpia
- 4 Termochemia
- 4.1 Entalpia to rozległa wielkość termodynamiczna
- 5 Ćwiczenia rozwiązane
- 5.1 - Ćwiczenie 1
- 5.2 - Ćwiczenie 2
- 6 Odnośniki
Definicja
Reakcje chemiczne to procesy termodynamiczne, które zwykle zachodzą pod stałym ciśnieniem i bardzo często pod ciśnieniem atmosferycznym. Ten typ procesów termodynamicznych nazywany jest „izobarycznym”, ponieważ zachodzi pod stałym ciśnieniem.
W tym przypadku pierwszą zasadę termodynamiki można zapisać w ten sposób:
Qp = ΔU + P ∙ ΔV
Gdzie Qp wskazuje, że ciepło zostało wymienione przy stałym ciśnieniu. Jeśli w poprzednim wyrażeniu wprowadzimy definicję entalpii H = U + P ∙ V, otrzymamy:
Qp = ΔH
Stąd dodatnia zmiana entalpii wskazuje na reakcję, która odebrała ciepło z otoczenia. To jest reakcja endotermiczna.
Wręcz przeciwnie, jeśli zmiana entalpii jest ujemna, jest to reakcja egzotermiczna.
W rzeczywistości słowo entalpia pochodzi od greckiego słowa enthalpien, którego znaczenie to „ogrzać”.
Entalpia jest często nazywana również ciepłem. Ale powinno być jasne, że to nie to samo co ciepło, ale to wymiana ciepła podczas procesu termodynamicznego zmienia entalpię.
Związek z ciepłem
W przeciwieństwie do ciepła entalpia jest funkcją stanu. Podczas obliczania zmiany entalpii obliczana jest różnica dwóch funkcji, które zależą wyłącznie od stanu układu, takich jak energia wewnętrzna i objętość..
ΔH = ΔU + P ∙ ΔV
Ponieważ ciśnienie w reakcji pozostaje stałe, entalpia reakcji jest funkcją stanu, która zależy tylko od energii wewnętrznej i objętości..
W reakcji chemicznej entalpię reagentów można zdefiniować jako sumę każdego z nich; a iloczynów jako suma entalpii wszystkich iloczynów.
Zmiana entalpii w reakcji to różnica między produktami a reagentami:
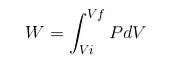
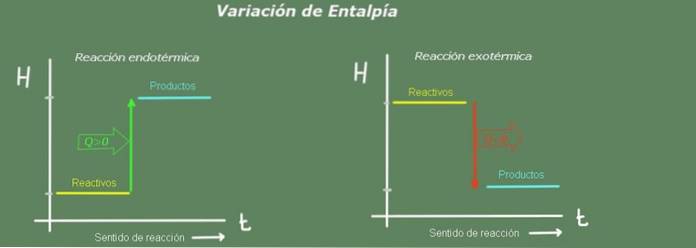
W reakcji endotermicznej entalpia produktów jest większa niż entalpii reagentów; to znaczy, że reakcja odbiera ciepło z otoczenia. Wręcz przeciwnie, w reakcji egzotermicznej entalpia reagentów jest większa niż produktów, ponieważ reakcja oddaje ciepło do otoczenia.
Standardowa entalpia
Ponieważ zmiana entalpii w reakcji chemicznej może zależeć od ciśnienia i temperatury, zwykle definiuje się standardowe warunki reakcji:
Standardowa temperatura reakcji: 25 ° C.
Standardowe ciśnienie reakcji: 1 atm = 1 bar.
Standardowa entalpia jest oznaczona w następujący sposób: H °
Termochemia
W równaniu termochemicznym liczą się nie tylko reagenty i produkty, ale także zmienność entalpii. Entalpia rozumiana jest jako reakcja na zmianę, która nastąpiła w tym samym czasie.
Jako przykład spójrzmy na następujące reakcje:
2 H2 (gaz) + O2 (gaz) → 2 H2O (ciecz); ΔH ° = -571,6 kJ (egzotermiczna).
H2 (gaz) + (½) O2 (gaz) → H2O (ciecz); ΔH ° = -285,8 kJ (egzotermiczna).
2 H2O (ciecz) → 2 H2 (gaz) + O2 (gaz); ΔH ° = +571,6 kJ (endotermiczna).
Entalpia to rozległa wielkość termodynamiczna
Jeśli warunki równania chemicznego są pomnożone lub podzielone przez pewien czynnik, to entalpia jest mnożona lub dzielona przez to samo.
Jeśli reakcja jest odwrócona, odwrócony jest również znak entalpii reakcji.
Rozwiązane ćwiczenia
-Ćwiczenie 1
Gaz acetylenowy C2H2 otrzymywany jest w wyniku reakcji węglika wapnia CaC2 w postaci granulatu z wodą w temperaturze i ciśnieniu otoczenia..
Jako dane mamy entalpie tworzenia reagentów:
ΔH ° (CaC2) = -59,0 kJ / mol
ΔH ° (H20) = -285,8 kJ / mol
A entalpia tworzenia produktów:
ΔH ° (C2H2) = +227,0 kJ / mol
ΔH ° (Ca (OH) 2) = -986,0 kJ / mol
Znajdź standardową entropię reakcji.
Rozwiązanie
Pierwszą rzeczą jest zaproponowanie zbilansowanego równania chemicznego:
CaC2 (s) + 2H20 (l) → Ca (OH) 2 (s) + C2H2 (g)
A teraz entalpie reagentów, produktów i reakcji:
- Odczynniki: -59,0 kJ / mol -2 ∙ 285,8 kJ / mol = -630,6 kJ / mol
- Produkty: -986,0 kJ / mol + 227,0 kJ / mol = -759 kJ / mol
- Reakcja: ΔH ° = -759 kJ / mol - (-630 kJ / mol) = -129 kJ / mol
Jest to reakcja egzotermiczna.
-Ćwiczenie 2
Ile ciepła zostaje oddane, gdy spalany jest 1 litr acetylenu w standardowych warunkach?
Rozwiązanie
Po zbilansowaniu reakcja spalania acetylenu wygląda następująco:
C2H2 (g) + (5/2) O2 (g) → 2 CO2 (g) + H20 (l)
Potrzebujemy entalpii tworzenia produktów:
ΔH ° (CO2) = -393,5 kJ / mol
ΔH ° (H2O (l)) = -285,8 kJ / mol
Obliczanie entalpii
Na podstawie tych danych możemy obliczyć entalpię produktów:
ΔH ° (produkty) = 2 * (- 393,5 kJ / mol) + (-285,8 kJ / mol) = -1072,8 kJ / mol
I entalpia tworzenia reagentów:
ΔH ° (C2H2) = 227,0 kJ / mol
ΔH ° (O2) = 0,0 kJ / mol
Entalpia reagentów będzie wynosić:
227,0 kJ / mol + (5/2) * 0,0 = 227,0 kJ / mol
Entalpia reakcji molowej będzie wówczas wynosić: ΔH ° (produkty) - ΔH ° (reagenty) = -1072,8 kJ / mol - 227,0 kJ / mol = -1299,8 kJ / mol
Entalpia spalania
Teraz musimy wiedzieć, ile moli acetylenu przypada na litr acetylenu w standardowych warunkach. W tym celu użyjemy równania stanu gazu doskonałego, z którego obliczymy liczbę moli.
Liczba moli n = P * V / (R * T)
P = 1 atm = 1,013 x 10⁵ Pa
V = 1 l = 1,0 x 10 ^ -3 m³
R = 8,31 J / (mol * K)
T = 25 ° C = 298,15 K.
n = 0,041 mola
Entalpia spalania 1 litra acetylenu wynosi 0,041 mola * (-1299,8 kJ / mol) = -53,13 kJ
Znak ujemny wskazuje, że jest to reakcja egzotermiczna, która wydziela 53,13 kJ = 12,69 kcal.
Bibliografia
- Kasztany E. Entalpia w reakcjach chemicznych. Odzyskany z: lidiaconlaquimica.wordpress.com
- Termochemia. Entalpia reakcji. Odzyskane z: recursostic.educacion.es
- Termochemia. Definicja standardowej entalpii reakcji. Odzyskany z: quimitube.com
- Wikipedia. Standardowa entalpia reakcji. Odzyskane z: wikipedia.com
- Wikipedia. Entalpia formacji. Odzyskane z: wikipedia.com



Jeszcze bez komentarzy