
Etapy erytropoezy i ich charakterystyka, regulacja, używki
Plik erytropoeza Jest to proces, w którym powstają czerwone krwinki lub erytrocyty. Te krwinki u ludzi żyją średnio 4 miesiące i nie są w stanie rozmnażać się. Z tego powodu należy stworzyć nowe erytrocyty, aby zastąpić te, które umierają lub giną w krwotokach..
U mężczyzn liczba czerwonych krwinek wynosi około 54 miliony na mililitr, podczas gdy u kobiet jest nieco mniej (48 milionów). Codziennie ginie około 10 milionów erytrocytów, więc podobną ilość trzeba wymienić.
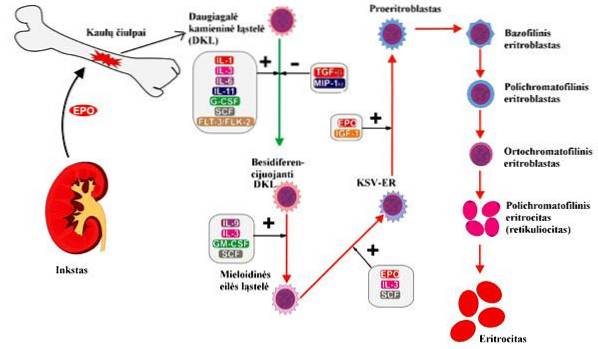
Erytrocyty powstają z jądrzastych erytroblastów obecnych w czerwonym szpiku kostnym ssaków, podczas gdy u innych kręgowców powstają głównie w nerkach i śledzionie.
Kiedy dobiegają końca swoich dni, rozpadają się; następnie obejmują je komórki zwane makrofagami. Te makrofagi są obecne w wątrobie, czerwonym szpiku kostnym i śledzionie..
Kiedy czerwone krwinki zostaną zniszczone, żelazo jest zawracane do ponownego użycia, podczas gdy reszta hemoglobiny jest przekształcana w barwnik żółci zwany bilirubiną..
Erytropoezę stymuluje hormon zwany erytropoetyną, ale proces ten jest regulowany przez różne czynniki, takie jak między innymi temperatura, ciśnienie tlenu..
Indeks artykułów
- 1 Etapy i ich charakterystyka
- 1.1 Jednostki tworzące kolonie 1-pękające
- 1.2 Komórki tworzące kolonie 2-erytroidowe
- 1.3 3-Proerytroblasty
- 1.4 4-bazofilne erytroblasty
- 1,5 5-polichromatofilne erytroblasty
- 1.6 7-retikulocyty
- 1,7 8-erytrocyty
- 2 Regulacja erytropoezy
- 2.1 Ciśnienie tlenu
- 2.2 Testosteron
- 2.3 Temperatura
- 2.4 Regulacja parakrynna
- 3 Środki pobudzające erytropoezę
- 3.1 Sztuczne PZE
- 4 Nieskuteczna erytropoeza
- 4.1 Wady syntezy kwasów nukleinowych
- 4.2 Wady syntezy grupy hemu
- 4.3 Wady w syntezie globiny
- 5 Referencje
Etapy i ich charakterystyka
U organizmów dorosłych erytropoeza występuje w wyspecjalizowanych miejscach w czerwonym szpiku kostnym zwanych wyspami erytroblastycznymi. Aby powstały erytrocyty, musi wystąpić kilka procesów, od proliferacji komórek do dojrzewania czerwonych krwinek, przechodzących przez różne etapy różnicowania komórek..
Gdy komórki ulegają podziałom mitotycznym, ich rozmiar i rozmiar jądra zmniejszają się, a także kondensacja chromatyny i hemoglobinizacja. Dodatkowo oddalają się od obszaru pochodzenia.
W końcowych stadiach stracą jądro i inne organelle i wejdą do krążenia, migrując przez cytoplazmatyczne pory komórek śródbłonka..
Niektórzy autorzy dzielą cały proces erytropoezy na dwie fazy, pierwszą z proliferacji i różnicowania komórek; podczas gdy inni dzielą proces w oparciu o specyficzne cechy komórki na każdym etapie, obserwowane za pomocą barwienia Wrighta. Na podstawie tego ostatniego etapy erytropoezy to:
Jednostki tworzące kolonie 1-Burst
Są pierwszymi komórkami wrażliwymi na erytropoetynę, niektórzy autorzy nazywają je mieloidalnymi komórkami progenitorowymi lub też BFU-E, od angielskiego akronimu. Charakteryzują się ekspresją antygenów powierzchniowych, takich jak CD34, a także obecnością receptorów erytropoetyny w niewielkich ilościach.
Komórki tworzące kolonie 2-erytroidów
W języku angielskim skracane jako CFU-E, są zdolne do wytwarzania małych kolonii erytroblastów. Inną cechą charakterystyczną tych komórek jest to, że ilości receptorów erytropoetyny są znacznie wyższe niż w jednostkach tworzących kolonie typu burst..
3-proerytroblasty
Uważany za pierwszy etap dojrzewania erytrocytów. Charakteryzują się dużym rozmiarem (według jednych od 14 do 19 µm, według innych do 25 µm). Jądro jest zaokrąglone i zawiera również jąderka i obfitą chromatynę.
Uważany za pierwszy etap dojrzewania erytrocytów. Charakteryzują się dużym rozmiarem (według jednych od 14 do 19 µm, według innych do 25 µm). Jądro jest duże, zaokrąglone, z chromatyną ułożoną w postaci włókienek i 2 lub 3 jąderkami.
Na tym etapie rozpoczyna się pobieranie żelaza plazmowego. Ich okres półtrwania wynosi 20 godzin, aby przejść przez mitozę do następnego etapu.
Erytroblasty 4-bazofilne
Nazywane również normoblastami, są mniejsze od swoich prekursorów. Komórki te wybarwiają się na niebiesko z witalnym barwieniem, to znaczy są zasadofilne. Jądro jest zagęszczone, jąderka zniknęły i mają dużą liczbę rybosomów. Na tym etapie rozpoczyna się synteza hemoglobiny.
Początkowo znane są jako erytroblasty zasadochłonne typu I, a po podziale mitotycznym przekształcają się w typ II, które pozostają bazofilami i wykazują większą syntezę hemoglobiny. Przybliżony czas trwania obu komórek łącznie jest podobny do czasu proerytroblastów.
5-polichromatofilne erytroblasty
Powstają w wyniku mitotycznego podziału zasadochłonnych erytroblastów typu II i są ostatnimi komórkami zdolnymi do podziału na drodze mitozy. Ich wielkość waha się od 8 do 12 µm, a rdzeń jest zaokrąglony i zagęszczony.
Cytoplazma tych komórek zabarwia się na szaro z barwnikiem Wrighta. Ma wysokie stężenie hemoglobiny, a liczba rybosomów pozostaje wysoka.
6-ortochromatyczne erytroblasty
Kolor tych komórek jest różowy lub czerwony ze względu na ilość hemoglobiny, którą mają. Jego rozmiar jest nieco mniejszy niż jego prekursorów (7 do 10 µm) i ma małe jądro, które zostanie wydalone przez egzocytozę, gdy komórki dojrzeją..
7-retikulocyty
Powstają w wyniku różnicowania erytroblastów ortochromowych, tracą organelle i wypełniają swoją cytoplazmę hemoglobiną. Pozostają w czerwonym szpiku kostnym przez dwa do trzech dni, aż migrują do krwi, gdzie zakończą dojrzewanie..
8-erytrocyty
Są to dojrzałe uformowane elementy, końcowy produkt erytropoezy, które powstają w wyniku dojrzewania retikulocytów. Mają kształt dwuwklęsły z powodu braku jądra i interakcji między cytoszkieletem erytrocytów a dwoma białkami zwanymi spektyną i aktyną.
Są to najbardziej obfite komórki krwi, powstają z retikulocytów. U ssaków mają kształt dwuwklęsły z powodu braku jądra i interakcji między cytoszkieletem erytrocytów a dwoma białkami zwanymi spektyną i aktyną. U innych kręgowców są zaokrąglone i zachowują jądro.
Regulacja erytropoezy
Chociaż erytropoetyna stymuluje tworzenie czerwonych krwinek, aby poprawić zdolność krwi do przenoszenia tlenu, istnieje kilka podstawowych mechanizmów regulujących tę formację, w tym:
Ciśnienie tlenu
Stężenie tlenu we krwi reguluje erytropoezę. Kiedy to stężenie jest bardzo niskie w dopływie krwi do nerek, stymulowana jest produkcja czerwonych krwinek..
To niskie stężenie tkankowego O2 może wystąpić z powodu hipoksemii, anemii, niedokrwienia nerek lub gdy powinowactwo hemoglobiny do tego gazu jest wyższe niż normalnie..
Miescher w 1893 jako pierwszy zasugerował związek między niedotlenieniem tkanek a erytropoezą. Jednak ta hipoksja nie stymuluje bezpośrednio szpiku kostnego do wytwarzania czerwonych krwinek, jak sugerował Miescher. Wręcz przeciwnie, pobudza nerki do produkcji hormonu erytropoetyny.
Produkcja erytropoetyny w wyniku niedotlenienia tkanek jest regulowana genetycznie, a receptory wykrywające takie niedotlenienie znajdują się w nerkach. Produkcja erytropoetyny jest również zwiększona z powodu spadku ciśnienia parcjalnego tlenu w tkankach po krwawieniu..
Komórki wytwarzające erytropoetynę znajdują się w nerkach i wątrobie. Wzrost produkcji tego hormonu podczas anemii wynika ze wzrostu liczby komórek, które go produkują..
Testosteron
Testosteron pośrednio reguluje erytropoezę poprzez regulację poziomu żelaza we krwi. Hormon ten działa bezpośrednio na działanie białka cytoplazmatycznego zwanego BMP-Smad (białko morfogenetyczne kości-Smad) w hepatocytach.
Dzięki działaniu testosteronu następuje supresja transkrypcji hepcydyny. Ta hepcydyna zapobiega przenikaniu żelaza z komórek do osocza z makrofagów, które przetwarzają żelazo, co prowadzi do drastycznego spadku poziomu żelaza we krwi.
Kiedy wystąpi hipoferremia, nastąpi zahamowanie erytropoetyny, ponieważ nie będzie żelaza do produkcji erytrocytów.
Temperatura
Wykazano, że temperatura ma wpływ na erytripoezę. Narażenie na bardzo niskie temperatury powoduje konieczność wytworzenia ciepła w tkaninie.
Wymaga to zwiększenia liczby erytrocytów w celu dostarczania tlenu do tkanek obwodowych. Nie jest jednak do końca jasne, w jaki sposób dochodzi do tego rodzaju regulacji..
Regulacja parakrynowa
Wygląda na to, że neurony ośrodkowego układu nerwowego wytwarzają erytropoetynę w celu ochrony przed uszkodzeniem niedokrwiennym i apoptozą. Jednak naukowcom nie udało się jeszcze tego zweryfikować..
Środki pobudzające erytropoezę
Czynniki stymulujące erytropoezę (ESA) to czynniki odpowiedzialne za stymulację produkcji erytrocytów. Erytropoetyna jest hormonem naturalnie odpowiedzialnym za ten proces, ale są też produkty syntetyczne o podobnych właściwościach.
Erytropoetyna jest hormonem syntetyzowanym głównie w nerkach. We wczesnych stadiach rozwoju wątroba bierze również udział w aktywnej produkcji erytropoetyny. Jednak wraz z postępem rozwoju ten ostatni organ jest mniej zaangażowany w ten proces..
Erytrocyt zaczyna rozpraszać receptory erytropoetyny na powierzchni błony. Erytropoetyna aktywuje szereg kaskad transdukcji sygnału międzykomórkowego, które początkowo wytwarzają syntezę hemoglobiny i powodują szybsze działanie retikulocytów i ich uwalnianie do krwiobiegu..
Sztuczne PZE
Sztuczne PZE są podzielone na generacje (od pierwszej do trzeciej), w zależności od daty ich utworzenia i wprowadzenia na rynek. Strukturalnie i funkcjonalnie podobny do erytropoetyny.
PZE pierwszej generacji są znane jako epoetyna alfa, beta i delta. Pierwsze dwa są wytwarzane przez rekombinację z komórek zwierzęcych i mają w organizmie okres półtrwania około 8 godzin. Tymczasem delta epoetyny jest syntetyzowana z ludzkich komórek.
Darbepoetyna alfa to ESA drugiej generacji, wytwarzany z komórek chomika chińskiego przy użyciu technologii zwanej rekombinowanym DNA. Ma okres półtrwania ponad trzy razy dłuższy niż ESA pierwszej generacji. Podobnie jak w przypadku epoetyn, niektórzy sportowcy wyczynowi używają darbepoetyny jako środka dopingującego.
Ciągły aktywator receptora erytropoetyny (ang. Continuous Erythropoetin Receptor Activator, CERA od angielskiego akronimu) to ogólna nazwa ESA trzeciej generacji. Nie próbują symulować struktury i funkcji erytropoetyny, ale działają poprzez stymulację receptora erytropoetyny, zwiększając w ten sposób jej działanie..
Jego okres półtrwania wynosi kilka tygodni zamiast godzin, jak w przypadku poprzednich leków. Używany komercyjnie od 2008 r., Jednak jego nielegalne wykorzystanie w działalności sportowej najwyraźniej sięga dwa lub trzy lata przed legalną komercjalizacją.
Nieskuteczna erytropoeza
Nieefektywna lub nieskuteczna erytropoeza występuje, gdy utworzone krwinki czerwone są uszkodzone i są zwykle niszczone przed lub wkrótce po opuszczeniu szpiku kostnego..
Nieskuteczna erytropoeza może wynikać z defektów w syntezie kwasów nukleinowych, grupy hemu lub globin. Te wady powodują różne rodzaje anemii.
Defekty w syntezie kwasów nukleinowych
W takim przypadku występuje niedobór kwasu foliowego i kobalaminy, hamowana jest synteza DNA w jądrze komórek promotorowych erytrocytów, przez co nie są one zdolne do podziałów mitotycznych. Z kolei cytoplazma zwiększa swoją objętość (makrocytoza), dając początek dużej komórce zwanej megaloblastem.
W takich przypadkach powstaje seria anemii zwanych anemiami megaloblastycznymi, z których najczęstszą jest niedokrwistość złośliwa. W tej chorobie w jelicie cienkim nie dochodzi do wchłaniania witaminy B12.
Inne przyczyny niedokrwistości megaloblastycznej obejmują choroby przewodu pokarmowego, złe wchłanianie, niedobór kwasu foliowego i niektóre leki.
Objawy tego typu anemii obejmują nieprawidłową bladość, drażliwość, utratę apetytu, biegunkę, trudności w chodzeniu lub osłabienie mięśni. W zależności od przyczyny można go leczyć suplementami witaminowymi lub kwasem foliowym..
Wady syntezy grupy hemu
Nieskuteczna erytropoeza spowodowana niedoborem syntezy żelaza może powodować dwa rodzaje anemii; niedokrwistość mikrocytarna z niedoboru żelaza i niedokrwistość syderoblastyczna.
Niedokrwistość mikrocytarna jest znana jako grupa anemii charakteryzujących się małymi i bladymi czerwonymi krwinkami, mogą mieć różne pochodzenie, w tym talasemię i nieskuteczną erytropoezę.
Poziomy żelaza i hemosyderyny są bardzo wysokie w przypadku niedokrwistości syderoblastycznej. Hemosiderin to żółty pigment pochodzący z hemoglobiny, który pojawia się, gdy poziom metalu jest wyższy niż normalnie. Ten typ anemii powoduje śmierć bazofili w czerwonym szpiku kostnym i nie dochodzi do syntezy hemoglobiny.
Nazywa się to niedokrwistością syderoblastyczną, ponieważ erytrocyty rozwijają się nieprawidłowo z powodu gromadzenia się żelaza w postaci granulek, które otrzymują nazwę syderoblastów. Niedokrwistość syderoblastyczna może być wrodzona lub wtórna i mieć różne przyczyny.
Defekty w syntezie globiny
W takim przypadku dochodzi do anemii sierpowatej i talasemii beta. Anemia sierpowata jest również znana jako anemia sierpowata. Jest wytwarzany przez mutację genetyczną, która prowadzi do zastąpienia kwasu glutaminowego waliną podczas syntezy beta globiny.
Z powodu tej substytucji zmniejsza się powinowactwo hemoglobiny do tlenu i dochodzi do atrofii erytrocytów, przybierając kształt sierpa zamiast normalnego dwuwklęsłego krążka. Pacjent z anemią sierpowatą jest podatny na mikrozawały i hemolizę.
Talasemia jest chorobą wywoływaną przez nieodpowiednie kodowanie genetyczne α- i β-globin, które prowadzi do przedwczesnej śmierci erytrocytów. Istnieje około stu różnych mutacji, które mogą powodować talasemię o różnym nasileniu.
Bibliografia
- Erithropoiesis. Na Wikipedii. Odzyskany z en.wikipedia.org.
- J.P. Labbrozzi (2015). Produkcja erytrocytów z komórek CD34+ krew pępowinowa. Praca doktorska. Uniwersytet Autonomiczny w Barcelonie. Hiszpania.
- H. Parrales (2018). Fizjologia erytropoezy. Odzyskany z cerebromedico.com.
- Niedokrwistość. Na Wikipedii. Odzyskany z en.wikipedia.org.
- Środek pobudzający erytropoezę. Na Wikipedii. Odzyskany z en.wikipedia.org.
- Nieskuteczna eritropoeza. Na Wikipedii. Odzyskany z en.wikipedia.org.


Jeszcze bez komentarzy