
Czwartorzędowa budowa charakterystycznych białek
Plik struktura czwartorzędowa białek definiuje relacje przestrzenne między każdą z jej podjednostek polipeptydowych połączonych siłami niekowalencyjnymi. W białkach polimerowych każdy z łańcuchów polipeptydowych, które go tworzą, nazywany jest podjednostkami lub protomerami.
Białka mogą składać się z jednego (monomerycznego), dwóch (dimerycznego), kilku (oligomerycznych) lub wielu protomerów (polimerycznych). Te protomery mogą mieć podobną lub bardzo różną strukturę molekularną. W pierwszym przypadku mówi się, że są to białka homotypowe, aw drugim heterotypowe.
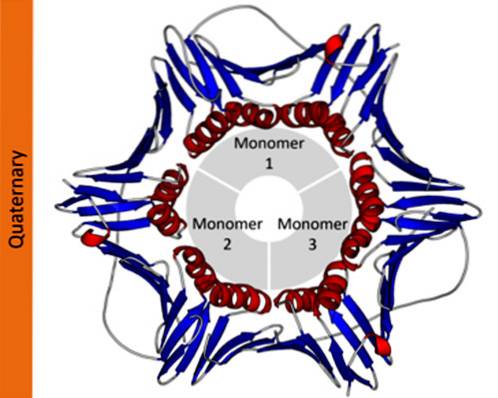
W notacji naukowej biochemicy używają greckich liter w dolnym indeksie do opisania składu protomerowego białek. Na przykład tetrameryczne białko homotypowe jest oznaczone jako α4, podczas gdy białko tetrameryczne składające się z dwóch różnych dimerów jest oznaczone jako αdwaβdwa.
Indeks artykułów
- 1 Struktura białka
- 1.1 Struktura podstawowa
- 1.2 Struktura drugorzędna
- 1.3 Struktura trzeciorzędowa
- 1.4 Struktura czwartorzędowa
- 2 Stabilność struktury czwartorzędowej
- 2.1 Oddziaływania hydrofobowe
- 2.2 Interakcje Van der Waalsa
- 2.3 Interakcje obciążenie-obciążenie
- 2.4 Wiązania wodorowe
- 2.5 Oddziaływania dipoli
- 3 Interakcje między protomerami
- 3.1 Interakcje homotypowe
- 3.2 Interakcje heterotypowe
- 4 Odnośniki
Struktura białka
Białka to złożone cząsteczki, które przyjmują różne trójwymiarowe konfiguracje. Te konfiguracje są unikalne dla każdego białka i pozwalają im wykonywać bardzo specyficzne funkcje. Poniżej przedstawiono poziomy organizacji strukturalnej białek.
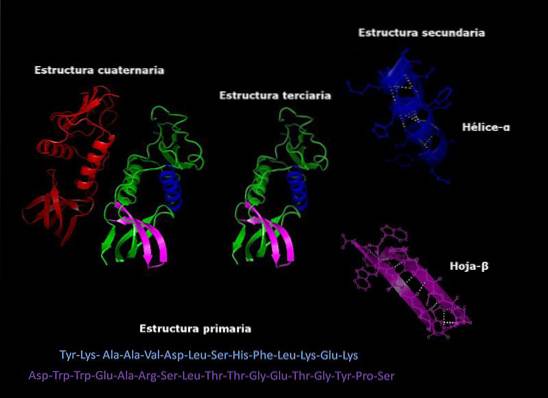
Struktura podstawowa
Odnosi się do sekwencji, w której różne aminokwasy są ułożone w łańcuchu polipeptydowym. Sekwencja ta jest określona przez sekwencję DNA, która koduje wspomniane białko.
Struktura drugorzędna
Większość białek nie jest w pełni wydłużonymi długimi łańcuchami aminokwasów, ale raczej ma regiony, które są regularnie składane w helisy lub arkusze. To fałdowanie jest tym, które otrzymuje nazwę struktury drugorzędowej.
Struktura trzeciorzędowa
Złożone obszary struktury pomocniczej można z kolei złożyć i złożyć w bardziej zwarte konstrukcje. To ostatnie fałdowanie nadaje białku trójwymiarowy kształt..
Struktura czwartorzędowa
W białkach, które składają się z więcej niż jednej podjednostki, struktury czwartorzędowe to relacje przestrzenne istniejące między każdą podjednostką, które są połączone wiązaniami niekowalencyjnymi..
Stabilność struktury czwartorzędowej
Trójwymiarowa struktura białek jest stabilizowana przez oddziaływania słabe lub niekowalencyjne. Chociaż te wiązania lub interakcje są znacznie słabsze niż zwykłe wiązania kowalencyjne, jest ich wiele, a ich skumulowany efekt jest potężny. Tutaj zobaczymy niektóre z najczęstszych interakcji.
Oddziaływania hydrofobowe
Niektóre aminokwasy zawierają hydrofobowe łańcuchy boczne. Gdy białka zawierają te aminokwasy, fałdowanie cząsteczki kieruje te łańcuchy boczne do wnętrza białka i chroni je przed wodą. Charakter różnych łańcuchów bocznych oznacza, że przyczyniają się one w różny sposób do efektu hydrofobowego..
Interakcje Van der Waalsa
Te interakcje zachodzą, gdy cząsteczki lub atomy, które nie są związane wiązaniami kowalencyjnymi, zbliżają się do siebie zbyt blisko i z tego powodu ich zewnętrzne orbitale elektroniczne zaczynają się nakładać..
W tym momencie między tymi atomami ustala się odpychająca siła, która rośnie bardzo szybko, gdy zbliżają się ich odpowiednie centra. Są to tak zwane „siły van der Waalsa”.
Interakcje obciążenie-obciążenie
Jest to oddziaływanie elektrostatyczne zachodzące między parą naładowanych cząstek. W białkach ten rodzaj interakcji zachodzi, zarówno ze względu na ładunek elektryczny netto białka, jak i na indywidualny ładunek zawartych w nim jonów. Ten rodzaj interakcji jest czasami nazywany mostem solnym..
Wiązania wodorowe
Wiązanie wodorowe powstaje między atomem wodoru kowalencyjnie związanym z grupą donorową wiązania wodorowego a parą wolnych elektronów należących do grupy akceptora wiązania.
Ten typ wiązania jest bardzo ważny, ponieważ właściwości wielu cząsteczek, w tym wody i cząsteczek biologicznych, są w dużej mierze spowodowane wiązaniami wodorowymi. Ma wspólne właściwości wiązań kowalencyjnych (elektrony są wspólne), a także oddziaływań niekowalencyjnych (interakcja ładunek-ładunek).
Interakcje dipolowe
W cząsteczkach, w tym białkach, które nie mają ładunku sieciowego, może wystąpić nierównomierny układ ich ładunków wewnętrznych, przy czym jeden skrajny poziom jest nieco bardziej ujemny niż drugi. To właśnie jest znane jako dipol.
Ten stan dipolarny cząsteczki może być trwały, ale można go również wywołać. Dipole mogą być przyciągane do jonów lub innych dipoli. Jeśli dipole są trwałe, oddziaływanie ma szerszy zakres niż to, które występuje w przypadku dipoli indukowanych.
Oprócz tych niekowalencyjnych oddziaływań, niektóre białka oligomeryczne stabilizują swoją czwartorzędową strukturę poprzez rodzaj wiązania kowalencyjnego, wiązania disiarczkowego. Są one ustalane między grupami sulfhydrylowymi cystein różnych protomerów.
Wiązania disiarczkowe pomagają również stabilizować drugorzędową strukturę białek, ale w tym przypadku łączą reszty cysteinylowe w ramach tego samego polipeptydu (wiązania dwusiarczkowe intrapolipeptydów)..
Interakcje między protomerami
Jak wspomniano powyżej, w białkach, które składają się z kilku podjednostek lub protomerów, podjednostki te mogą być podobne (homotypowe) lub różne (heterotypowe)..
Interakcje homotypowe
Podjednostki tworzące białko to asymetryczne łańcuchy polipeptydowe. Jednak w interakcjach homotypowych podjednostki te mogą łączyć się na różne sposoby, osiągając różne typy symetrii..
Oddziałujące grupy każdego protomeru są na ogół zlokalizowane w różnych pozycjach, dlatego nazywa się je interakcjami heterologicznymi. Heterologiczne interakcje między różnymi podjednostkami, czasami występują w taki sposób, że każda podjednostka jest skręcona w stosunku do poprzedniej, będąc w stanie osiągnąć strukturę helikalną.
W innych przypadkach interakcje zachodzą w taki sposób, że określone grupy podjednostek są rozmieszczone wokół jednej lub więcej osi symetrii, w tzw. Symetrii grup punktowych. Gdy istnieje kilka osi symetrii, każda podjednostka obraca się względem swojego sąsiada o 360 ° / n (gdzie n oznacza liczbę osi).
Wśród typów symetrii, które uzyskuje się w ten sposób, są na przykład helikalna, sześcienna i ikozaedryczna.
Kiedy dwie podjednostki oddziałują poprzez oś binarną, każda jednostka obraca się o 180 ° względem drugiej, wokół tej osi. Ta symetria jest znana jako symetria C.dwa. W nim miejsca interakcji w każdej podjednostce są identyczne; w tym przypadku nie mówimy o interakcji heterologicznej, ale o interakcji izologicznej.
Jeśli, przeciwnie, połączenie między dwoma składnikami dimeru jest heterologiczne, wówczas zostanie uzyskany asymetryczny dimer.
Interakcje heterotypowe
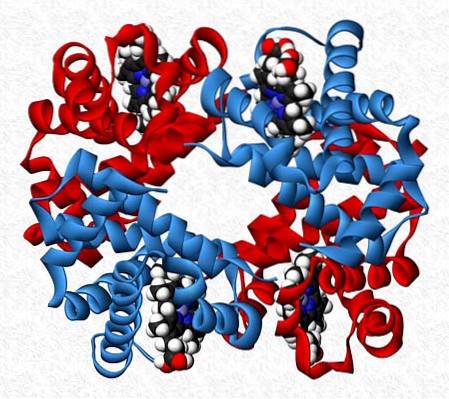
Oddziałujące ze sobą podjednostki w białku nie zawsze mają ten sam charakter. Istnieją białka, które składają się z dwunastu lub więcej różnych podjednostek.
Oddziaływania, które utrzymują stabilność białka, są takie same jak w oddziaływaniach homotypowych, ale generalnie uzyskuje się całkowicie asymetryczne cząsteczki..
Na przykład hemoglobina jest tetramerem, który ma dwie pary różnych podjednostek (αdwaβdwa).
Bibliografia
- C.K. Mathews, K.E. van Holde & K.G. Ahern (2002). Biochemestry. III edycja. Wydawnictwo Benjamin / Cummings, Inc..
- R.K. Murray, P. Mayes, D.C. Granner & V.W. Rodwell (1996). Biochemestry Harpera. Appleton & Lange
- J.M. Berg, J.L. Tymoczko i L. Stryer (2002). Biochemestry. Wydanie 5. W. H. Freeman and Company.
- J. Koolman & K.-H. Roehm (2005). Color Atlas of Biochemistry. Wydanie 2. Thieme.
- A. Lehninger (1978). Biochemia. Ediciones Omega, S.A..
- L. Stryer (1995). Biochemestry. W.H. Freeman and Company, Nowy Jork.



Jeszcze bez komentarzy