
Historia, właściwości, struktura, pozyskiwanie, zagrożenia, zastosowania fluoru
Plik fluor Jest to pierwiastek chemiczny reprezentowany przez symbol F i grupy główek 17, do których należą halogeny. Wyróżnia się ponad innymi elementami układu okresowego, jako najbardziej reaktywny i elektroujemny; reaguje z prawie wszystkimi atomami, więc tworzy niezliczone sole i związki fluoroorganiczne.
W normalnych warunkach jest to bladożółty gaz, który można pomylić z żółtawozielonym. W stanie ciekłym, pokazanym na poniższym obrazku, jego żółty kolor nieco się zintensyfikuje, który znika całkowicie, gdy zastygnie w punkcie zamarzania..

Taka jest jego reaktywność, pomimo lotnej natury jego gazu, że pozostaje uwięziony w skorupie ziemskiej; zwłaszcza w postaci mineralnego fluorytu, znanego z fioletowych kryształów. Podobnie, jego reaktywność sprawia, że jest to substancja potencjalnie niebezpieczna; reaguje energicznie na wszystko, czego dotknie i spala się w płomieniach.
Jednak wiele jego produktów ubocznych może być nieszkodliwych, a nawet korzystnych, w zależności od ich zastosowania. Na przykład najpopularniejszym zastosowaniem fluoru, dodawanego w postaci jonowej lub mineralnej (np. Sole fluorkowe), jest przygotowanie past z fluorem, które pomagają chronić szkliwo zębów..
Fluor ma tę właściwość, że może stabilizować wysokie liczby lub stany utlenienia wielu innych pierwiastków. Im wyższa liczba atomów fluoru, tym bardziej reaktywny jest związek (chyba że jest to polimer). Podobnie zwiększy się jego wpływ na matryce molekularne; na lepsze lub gorsze.
Indeks artykułów
- 1 Historia
- 1.1 Stosowanie fluorytu
- 1.2 Przygotowanie kwasu fluorowodorowego
- 1.3 Izolacja
- 1.4 Zainteresowanie fluorem
- 2 Właściwości fizyczne i chemiczne
- 2.1 Wygląd
- 2.2 Liczba atomowa (Z)
- 2.3 Masa atomowa
- 2.4 Temperatura topnienia
- 2.5 Temperatura wrzenia
- 2.6 Gęstość
- 2.7 Ciepło parowania
- 2,8 Molowa pojemność cieplna
- 2.9 Prężność par
- 2.10 Przewodność cieplna
- 2.11 Porządek magnetyczny
- 2.12 Zapach
- 2.13 stopnie utlenienia
- 2.14 Energia jonizacji
- 2.15 Elektroujemność
- 2.16 Środek utleniający
- 2.17 Reaktywność
- 3 Struktura i konfiguracja elektroniczna
- 3.1 Cząsteczka dwuatomowa
- 3.2 Ciecz i ciało stałe
- 4 Gdzie znaleźć i otrzymać
- 4.1 Przetwarzanie fluorytu
- 4.2 Elektroliza fluorowodoru
- 5 izotopów
- 6 Rola biologiczna
- 7 Ryzyka
- 7.1 Fluoroza zębów
- 7.2 Fluoroza szkieletu
- 8 zastosowań
- 8.1 Pasty do zębów
- 8.2 Fluoryzacja wody
- 8.3 Środek utleniający
- 8.4 Polimery
- 8.5 Farmaceuci
- 8.6 Wytrawianie szkła
- 8.7 Wzbogacanie uranu
- 9 Odniesienia
Fabuła
Stosowanie fluorytu
W 1530 roku niemiecki mineralog Georgius Agricola odkrył, że fluoryt mineralny może być używany do oczyszczania metali. Fluorspar to inna nazwa fluorytu, mineralnego fluoru składającego się z fluorku wapnia (CaFdwa).
Do tego czasu nie odkryto jeszcze pierwiastka fluoru, a „fluoir” w fluorycie pochodzi od łacińskiego słowa „fluere”, które oznacza „płynąć”; ponieważ właśnie to robił fluoryt lub fluoryt z metalami: pomagał im opuścić próbkę.
Przygotowanie kwasu fluorowodorowego
W 1764 roku Andreas Sigismud Margraffowi udało się przygotować kwas fluorowodorowy, ogrzewając fluoryt kwasem siarkowym. Szklane retorty zostały stopione pod działaniem kwasu, więc szkło zostało zastąpione metalami.
Jest to również przypisywane Carlowi Scheele w 1771 r., Wytwarzanie kwasu tą samą metodą, którą stosował Margraff. W 1809 roku francuski naukowiec Andre-Marie Ampere zaproponował, że kwas fluorowy lub fluorowodorowy jest związkiem składającym się z wodoru i nowego pierwiastka podobnego do chloru..
Naukowcy przez długi czas próbowali wyodrębnić fluor, używając kwasu fluorowodorowego; ale jego niebezpieczeństwo utrudniało postęp w tym sensie.
Humphry Davy, Joseph Louis Gay-Lussac i Jacques Thénard odczuwali silny ból, kiedy wdychali fluorowodór (kwas fluorowodorowy bez wody iw postaci gazowej). Naukowcy Paulin Louyet i Jerome Nickles zmarli z powodu zatrucia w podobnych okolicznościach.
Edmond Frémy, francuski badacz, próbował stworzyć suchy kwas fluorowodorowy, aby uniknąć toksyczności fluorowodoru poprzez zakwaszenie wodorofluorku potasu (KHFdwa), ale podczas elektrolizy nie było przewodzenia prądu elektrycznego.
Izolacja
W 1860 roku angielski chemik George Gore podjął próbę elektrolizy suchego kwasu fluorowodorowego i udało mu się wyizolować niewielką ilość gazowego fluoru. Jednak nastąpiła eksplozja, podczas której wodór i fluor gwałtownie się rekombinowały. Gore przypisał eksplozję wyciekowi tlenu..
W 1886 roku francuskiemu chemikowi Henri Moissonowi po raz pierwszy udało się wyodrębnić fluor. Wcześniej praca Moissona była czterokrotnie przerywana przez poważne zatrucie fluorowodorem podczas próby wyizolowania pierwiastka..
Moisson był uczniem Frémy'ego i polegał na swoich eksperymentach w celu wyizolowania fluoru. Moisson zastosował do elektrolizy mieszaninę fluorku potasu i kwasu fluorowodorowego. Powstały roztwór przewodził elektryczność i gaz fluorowy zebrany na anodzie; to znaczy na dodatnio naładowanej elektrodzie.
Moisson zastosował sprzęt odporny na korozję, w którym elektrody zostały wykonane ze stopu platyny i irydu. Podczas elektrolizy użył platynowego pojemnika i schłodził roztwór elektrolitu do temperatury -23ºF (-31ºC)..
Wreszcie, 26 czerwca 1886 roku, Henri Moisssonowi udało się wyodrębnić fluor, co pozwoliło mu zdobyć Nagrodę Nobla w 1906 roku..
Zainteresowanie fluorem
Na jakiś czas stracono zainteresowanie badaniami nad fluorem. Jednak rozwój Projektu Manhattan do produkcji bomby atomowej ponownie go przyspieszył.
Amerykańska firma Dupont opracowała w latach 1930-1940 produkty fluorowane, takie jak chlorofluorowęglowodory (Freon-12), stosowane jako czynniki chłodnicze; i plastik politetrafluoroetylenowy, lepiej znany pod nazwą Teflon. Spowodowało to wzrost produkcji i zużycia fluoru..
W 1986 r. Na konferencji około sto lat po wyodrębnieniu fluoru amerykański chemik Karl O. Christe przedstawił chemiczną metodę otrzymywania fluoru w reakcji zachodzącej między KdwaMnF6 i SbF5.
Fizyczne i chemiczne właściwości
Wygląd
Fluor to bladożółty gaz. W stanie ciekłym ma barwę jasnożółtą. Tymczasem ciało stałe może być nieprzezroczyste (alfa) lub przezroczyste (beta).
Liczba atomowa (Z)
9.
Masa atomowa
18,998 u.
Temperatura topnienia
-219,67 ° C.
Temperatura wrzenia
-188,11 ° C.
Gęstość
W temperaturze pokojowej: 1,696 g / l.
W temperaturze topnienia (ciecz): 1,505 g / ml.
Ciepło parowania
6,51 kJ / mol.
Molowa pojemność cieplna
31 J / (mol K).
Ciśnienie pary
W temperaturze 58 K ma prężność pary 986,92 atm.
Przewodność cieplna
0,0277 W / (m · K)
Porządek magnetyczny
Diamagnetyczny
Zapach
Charakterystyczny ostry i ostry zapach, wykrywalny nawet przy 20 ppb.
Liczby utleniania
-1, co odpowiada anionowi fluorkowemu F-.
Energia jonizacji
-Pierwsza: 1681 kJ / mol
-Po drugie: 3374 kJ / mol
-Po trzecie: 6147 KJ / mol
Elektroujemność
3,98 w skali Paulinga.
Jest to pierwiastek chemiczny o najwyższych elektroujemnościach; to znaczy ma duże powinowactwo do elektronów atomów, z którymi się łączy. Z tego powodu atomy fluoru generują duże momenty dipolowe w określonych obszarach cząsteczki..
Jej elektroujemność ma również inny efekt: związane z nią atomy tracą tak dużą gęstość elektronową, że zaczynają nabierać dodatniego ładunku; to znaczy dodatnia liczba utleniania. Im więcej atomów fluoru znajduje się w związku, tym centralny atom będzie miał bardziej dodatnią liczbę utleniania..
Na przykład w OFdwa tlen ma stopień utlenienia +2 (Odwa+fadwa-); w UF6, Uran ma stopień utlenienia +6 (U6+fa6-); to samo dzieje się z siarką w SF6 (S6+fa6-); i wreszcie jest AgFdwa, gdzie srebro ma nawet stopień utlenienia +2, co jest rzadkością.
Dlatego pierwiastki potrafią uczestniczyć z ich najbardziej dodatnimi stopniami utlenienia, gdy tworzą związki z fluorem..
Środek utleniający
Fluor jest najsilniejszym pierwiastkiem utleniającym, więc żadna substancja nie jest w stanie go utleniać; iz tego powodu nie występuje w naturze jako wolny.
Reaktywność
Fluor może łączyć się ze wszystkimi innymi pierwiastkami oprócz helu, neonu i argonu. W normalnych temperaturach nie atakuje również stali miękkiej ani miedzi. Reaguje gwałtownie z materiałami organicznymi, takimi jak guma, drewno i tkanina.
Fluor może reagować z ksenonem gazu szlachetnego, tworząc silnie utleniający difluorek ksenonu, XeFdwa. Reaguje również z wodorem, tworząc halogenek, fluorowodór, HF. Z kolei fluorowodór rozpuszcza się w wodzie, aby wytworzyć słynny kwas fluorowodorowy (w postaci szkła).
Kwasowość kwasów kwaśnych, sklasyfikowana w kolejności rosnącej, to:
HF < HCl < HBr < HI
Kwas azotowy reaguje z fluorem, tworząc azotan fluoru, FNO3. W międzyczasie kwas solny silnie reaguje z fluorem, tworząc HF, OFdwa i ClF3.
Struktura i konfiguracja elektroniczna

Cząsteczka dwuatomowa

Atom fluoru w stanie podstawowym ma siedem elektronów walencyjnych, które znajdują się na orbitali 2s i 2p zgodnie z konfiguracją elektronową:
[On] 2sdwa 2 P5
Teoria wiązań walencyjnych (VTE) stwierdza, że dwa atomy fluoru, F, są kowalencyjnie związane z każdym kompletnym oktetem walencyjnym.
Dzieje się to szybko, ponieważ wystarczy jeden elektron, aby stać się izoelektronicznym z gazem szlachetnym neonu; a jego atomy są bardzo małe, z bardzo silnym skutecznym ładunkiem jądrowym, który z łatwością wymaga elektronów z otoczenia.
Cząsteczka Fdwa (górne zdjęcie) ma pojedyncze wiązanie kowalencyjne F-F. Pomimo swojej stabilności w porównaniu z wolnymi atomami F, jest to wysoce reaktywna cząsteczka; homojądrowy, niepolarny i żądny elektronów. Dlatego fluor, podobnie jak F.dwa, jest to bardzo toksyczny i niebezpieczny gatunek.
Ponieważ Fdwa jest niepolarna, jej interakcje zależą od masy cząsteczkowej i londyńskich sił rozpraszających. W pewnym momencie chmura elektronowa wokół obu atomów F musi zdeformować się i stworzyć chwilowy dipol, który indukuje inny w sąsiedniej cząsteczce; tak, aby przyciągały się powoli i słabo.
Płynne i stałe
Cząsteczka Fdwa jest bardzo mały i stosunkowo szybko rozprzestrzenia się w przestrzeń. W fazie gazowej wykazuje bladożółty kolor (który można pomylić z limonkową). Gdy temperatura spadnie do -188 ºC, siły dyspersyjne stają się bardziej skuteczne i powodują, że cząsteczki F.dwa zlewają się wystarczająco, aby zdefiniować ciecz.
Ciekły fluor (pierwsze zdjęcie) wygląda na jeszcze bardziej żółty niż odpowiadający mu gaz. W nim cząsteczki Fdwa są bliżej i w większym stopniu oddziałują ze światłem. Co ciekawe, gdy zniekształcony sześcienny kryształ fluoru utworzy się w temperaturze -220 ° C, kolor blaknie i pozostaje jako przezroczysta substancja stała..
Teraz, gdy cząsteczki F.dwa są tak blisko (ale bez zatrzymania ich rotacji molekularnej), wydaje się, że ich elektrony uzyskują pewną stabilność i dlatego ich skok elektroniczny jest zbyt duży, aby światło mogło nawet oddziaływać z kryształem.
Fazy krystaliczne
Ten sześcienny kryształ odpowiada fazie β (nie jest alotropem, ponieważ nadal jest tym samym F.dwa). Gdy temperatura spada jeszcze bardziej, do -228 ºC, stały fluor przechodzi przemianę fazową; kryształ sześcienny staje się jednoskośny, faza α:
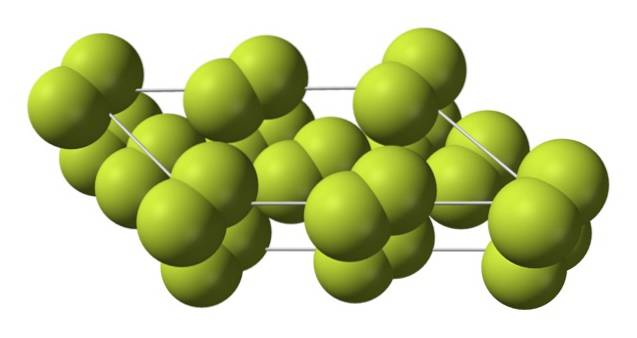
W przeciwieństwie do β-Fdwa, α-Fdwa jest nieprzejrzysty i twardy. Być może dlatego, że cząsteczki F.dwa nie mają już tyle swobody, by obracać się w ustalonych pozycjach na kryształach jednoskośnych; gdzie oddziałują w większym stopniu ze światłem, ale bez wzbudzania ich elektronów (co powierzchownie wyjaśniałoby ich nieprzezroczystość).
Struktura krystaliczna α-Fdwa było to trudne do zbadania konwencjonalnymi metodami dyfrakcji rentgenowskiej, ponieważ przejście z fazy β do α jest silnie egzotermiczne; więc kryształ praktycznie eksplodował, w tym samym czasie miał niewielką interakcję z promieniowaniem.
Minęło około pięćdziesięciu lat, zanim niemieccy naukowcy (Florian Kraus i wsp.) W pełni rozszyfrowali strukturę α-Fdwa dokładniej dzięki technikom dyfrakcji neutronów.
Gdzie znaleźć i uzyskać
Fluor zajmuje 24 miejsce wśród najpowszechniejszych pierwiastków we Wszechświecie. Jednak na Ziemi jest to masa 13vo pierwiastek o stężeniu 950 ppm w skorupie ziemskiej i 1,3 ppm w wodzie morskiej.
Gleby mają stężenie fluoru między 150 a 400 ppm, aw niektórych glebach może osiągnąć 1000 ppm. W powietrzu atmosferycznym występuje w stężeniu 0,6 ppb; ale w niektórych miastach odnotowano do 50 ppb.
Fluor pozyskiwany jest głównie z trzech minerałów: fluorytu lub fluorosparu (CaFdwa), fluoroapatyt [Ca5(PO4)3F] i kriolit (Na3AlF6).
Przetwarzanie fluorytu
Po zebraniu skał z mineralnym fluorytem poddaje się je pierwotnemu i wtórnemu kruszeniu. Przy wtórnym kruszeniu uzyskuje się bardzo małe fragmenty skał.
Fragmenty skały są następnie przenoszone do młyna kulowego w celu redukcji na proszek. Woda i odczynniki są dodawane w celu utworzenia pasty, którą umieszcza się w zbiorniku flotacyjnym. Powietrze jest wtryskiwane pod ciśnieniem, tworząc pęcherzyki, przez co fluoryt unosi się na powierzchni wody.
Krzemiany i węglany osadzają się, gdy fluoryt jest zbierany i przenoszony do pieców suszących..
Po uzyskaniu fluorytu poddaje się go reakcji z kwasem siarkowym w celu wytworzenia fluorowodoru:
CaFdwa + H.dwapołudniowy zachód4 => 2 HF + CaSO4
Elektroliza fluorowodoru
Przy produkcji fluoru stosuje się metodę zastosowaną przez Moissona w 1886 roku, z pewnymi modyfikacjami..
Elektrolizę przeprowadza się z mieszaniny stopionego fluorku potasu i kwasu fluorowodorowego w stosunku molowym od 1: 2,0 do 1: 2,2. Temperatura stopionej soli wynosi 70 - 130 ºC.
Katoda składa się ze stopu Monel lub stali, a anoda z węgla degrafitowego. Proces produkcji fluoru podczas elektrolizy można opisać w następujący sposób:
2HF => H.dwa + fadwa
Do chłodzenia komory elektrolitycznej używana jest woda, ale temperatura musi być wyższa od temperatury topnienia elektrolitu, aby uniknąć krzepnięcia. Wodór powstający podczas elektrolizy zbiera się na katodzie, a fluor na anodzie.
Izotopy
Fluor ma 18 izotopów, czyli 19Jedyny stabilny izotop z 100% liczebnością. Plik 18F ma okres półtrwania 109,77 minut i jest radioaktywnym izotopem fluoru o najdłuższym okresie półtrwania. Plik 18F jest używane jako źródło pozytonów.
Rola biologiczna
Nie jest znana aktywność metaboliczna fluoru u ssaków lub roślin wyższych. Jednak niektóre rośliny i gąbki morskie syntetyzują monofluorooctan, trujący związek, którego używają jako ochrony, aby zapobiec jego zniszczeniu.
Ryzyka
Nadmierne spożycie fluoru wiąże się z fluorozą kości u dorosłych i fluorozą zębów u dzieci, a także z zaburzeniami czynności nerek. Z tego powodu amerykańska publiczna służba zdrowia (PHS) zasugerowała, że stężenie fluoru w wodzie pitnej nie powinno przekraczać 0,7 mg / l..
W międzyczasie Agencja Ochrony Środowiska Stanów Zjednoczonych (EPA) ustaliła, że stężenie fluoru w wodzie pitnej nie powinno przekraczać 4 mg / l, aby uniknąć fluorozy szkieletowej, w której fluor gromadzi się w kościach. Może to prowadzić do osłabienia kości i złamań..
Fluor jest związany z uszkodzeniem przytarczyc, ze zmniejszeniem stężenia wapnia w strukturach kostnych i wysokim stężeniem wapnia w osoczu..
Wśród zmian przypisywanych nadmiarowi fluoru są: fluoroza zębów, fluoroza szkieletowa i uszkodzenie przytarczyc.
Fluoroza zębów
Fluoroza zębów objawia się małymi smugami lub plamkami na szkliwie zębów. Dzieci poniżej 6 roku życia nie powinny używać płynów do płukania ust zawierających fluor..
Fluoroza szkieletowa
W fluorozie szkieletowej można zdiagnozować ból i uszkodzenie kości, a także stawów. Kość może stwardnieć i stracić elastyczność, co zwiększa ryzyko złamań.
Aplikacje
Pasta do zębów

Rozpoczynamy od części poświęconej zastosowaniom fluoru, a jednym z najbardziej znanych jest stosowanie go jako składnika wielu past do zębów. Nie jest to jedyne zastosowanie, w którym docenia się kontrast między jego cząsteczką F.dwa, niezwykle trujący i niebezpieczny, a anion F-, które w zależności od środowiska mogą być korzystne (choć czasami nie).
Kiedy jemy, zwłaszcza słodycze, bakterie rozkładają je, zwiększając kwasowość naszej śliny. Następnie dochodzi do punktu, w którym pH jest wystarczająco kwaśne, aby degradować i demineralizować szkliwo zębów; hydroksyapatyt rozpada się.
Jednak w tym procesie jony F- współdziałać z Cadwa+ utworzyć matrycę fluorapatytu; bardziej stabilny i trwalszy niż hydroksyapatyt. A przynajmniej taki jest proponowany mechanizm wyjaśniający działanie anionu fluorkowego na zęby. Prawdopodobnie jest bardziej złożony i ma zależną od pH równowagę hydroksyapatyt-fluorapatyt.
Te aniony F- Są dostępne w zakładach stomatologicznych w postaci soli; takie jak: NaF, SnFdwa (słynny fluorek cynawy) i NaPOF. Jednak stężenie F- Musi być niski (mniej niż 0,2%), ponieważ w przeciwnym razie powoduje negatywny wpływ na organizm.
Fluoryzacja wody
Podobnie jak pasta do zębów, sole fluoru zostały dodane do źródeł wody pitnej w celu zwalczania próchnicy u osób, które ją piją. Stężenie powinno być nadal znacznie niższe (0,7 ppm). Jednak praktyka ta jest często przedmiotem nieufności i kontrowersji, ponieważ przypisuje się jej możliwe skutki rakotwórcze.
Środek utleniający
Gaz F.dwa zachowuje się jak bardzo silny środek utleniający. To powoduje, że wiele związków spala się szybciej niż w przypadku wystawienia na działanie tlenu i źródła ciepła. Dlatego znalazł zastosowanie w mieszankach paliw rakietowych, w których może nawet zastąpić ozon.
Polimery
W wielu zastosowaniach fluor nie jest spowodowany przez F.dwa lub F-, ale bezpośrednio do atomów elektroujemnych jako część związku organicznego. W istocie mówimy o łączu C-F..
W zależności od struktury, polimery lub włókna z wiązaniami C-F są zwykle hydrofobowe, dzięki czemu nie przemakają ani nie są odporne na atak kwasu fluorowodorowego; Albo jeszcze lepiej, mogą być doskonałymi izolatorami elektrycznymi i użytecznymi materiałami, z których wykonane są przedmioty, takie jak rury i uszczelki. Przykładami takich polimerów fluorowanych są teflon i nafion.
Farmaceuci
Reaktywność fluoru sprawia, że jego zastosowanie do syntezy wielu związków fluoru, organicznych lub nieorganicznych, jest wątpliwe. W organicznych, szczególnie tych o działaniu farmakologicznym, zastąpienie jednego z ich heteroatomów atomami F zwiększa (dodatnio lub ujemnie) ich działanie na ich biologiczny cel..
Dlatego w przemyśle farmaceutycznym zawsze chodzi o modyfikację niektórych leków poprzez dodanie atomów fluoru..
Bardzo podobnie dzieje się z herbicydami i fungicydami. Zawarty w nich fluor może zwiększyć ich działanie i skuteczność wobec szkodników owadów i grzybów..
Grawerowanie na szkle
Kwas fluorowodorowy ze względu na swoją agresywność w stosunku do szkła i ceramiki został użyty do grawerowania cienkich i delikatnych kawałków tych materiałów; zwykle przeznaczone do produkcji mikrokomponentów komputerów lub żarówek elektrycznych.
Wzbogacanie uranu
Jednym z najbardziej odpowiednich zastosowań pierwiastkowego fluoru jest wspomaganie wzbogacania uranu w postaci 235U. W tym celu minerały uranu są rozpuszczane w kwasie fluorowodorowym, wytwarzając UF4. Ten nieorganiczny fluorek reaguje następnie z Fdwa, aby w ten sposób przekształcić się w UF6 (235PHEW6 Y 238PHEW6).
Następnie i przez wirowanie gazu, plik 235PHEW6 oddziela się od 238PHEW6 do późniejszego utleniania i przechowywania jako paliwo jądrowe.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Krämer Katrina. (2019). Struktura zamrożonego fluoru została ponownie zbadana po 50 latach. Królewskie Towarzystwo Chemii. Źródło: chemistryworld.com
- Wikipedia. (2019). Fluor. Odzyskane z: en.wikipedia.org
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Fluor. Baza danych PubChem. CID = 24524. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Dr Doug Stewart. (2019). Fakty dotyczące pierwiastka fluoru. Chemicool. Źródło: chemicool.com
- Batul Nafisa Baxamusa. (2018, 21 lutego). Zaskakująco powszechne zastosowania wysoce reaktywnego fluoru. Odzyskany z: sciencestruck.com
- Paola Opazo Sáez. (04 lutego 2019). Fluor w paście do zębów: czy jest dobry czy zły dla twojego zdrowia? Odzyskany z: nacionfarma.com
- Karl Christe i Stefan Schneider. (08 maja 2019). Fluor: pierwiastek chemiczny. Encyclopædia Britannica. Odzyskany z: britannica.com
- Lenntech B.V. (2019). Układ okresowy: tlen. Odzyskany z: lenntech.com
- Gagnon Steve. (s.f.). Pierwiastek fluoru. Jefferson Lab. Pobrane z: education.jlab.org
- Zespół ds. Treści medycznych i redakcyjnych American Cancer Society. (28 lipca 2015). Fluoryzacja wody i ryzyko raka. Odzyskany z: cancer.org



Jeszcze bez komentarzy